

Quels sont les acides aminés qui peuvent être convertis en d'autres Ac. aminés par hydrolyse douce, avec libération d'ammoniaque?
Réponse
Seuls l'asparagine (Asn, N, dérivant de l'acide aspartique) et la glutamine (Gln, Q, dérivant de l'acide glutamique) peuvent générer d'autres Ac. aminés en libérant de l'ammoniac.
La dissolution de 1,812 g d'un acide aminé cristallisé (pK1: 2,4; pK2: 9,7) dans 100 mL de NaOH 0,1M donne une solution de pH 10,4. Calculez la masse moléculaire de cet acide aminé.
Réponse
L'addition de NaOH entraine le déplacement de l'équilibre acide-base de l'acide aminé vers la forme basique (dissociation): NH3+-CH(R)-COO- -->
NH2-CH(R)-COO-
L'équation d'Henderson-Hasselbach permet d'obtenir la proportion d'acide aminé sous forme de base et d'acide suite à l'addition de NaOH:
A pH 10,4 on est à pK2, environ, pH = pK2 + Log [base] / [acide] c.a.d. 10,4 = 9,7 + Log [base] / [acide]
0,7 = Log [base] / [acide], d'où 100,7 = [base] / [acide], soit: 5,011 = [base] / [acide].
Considérant que 0,01 mol de NaOH (100 ml de 0,1M) a été utilisée pour atteindre le pH 10,4, le nombre de moles de l'acide aminé converties en base est 0,01 mol/100 ml = [base]. Nous aurons donc: 5,011 = [base] / [acide] ou 5,011 = 0,01 mol /[acide], soit:
[acide] = 0,002 mol/100 ml.
La somme des quantités de l'acide aminé sous forme basique et sous forme acide donne la quantité totale d'acide aminé, soit 0,012 mol. Donc 1,812 g = 0,012 mol et le poids moléculaire en g / mol est 1,812 g /0,012 mol = 151 g / mol
Calculez le pI de l'histidine et tracez sa courbe de titrage. Indiquez la position du pI, des pKas, ainsi que le pourcentage des formes ioniques à chacun des pKas ainsi qu'au début et à la fin du titrage. Les pKas de l'Histidine sont pKa1: 1,8, pKaR: 6,00 et pKa2: 9,2
Le titrage de l'histidine implique les équilibres acide/base suivants:
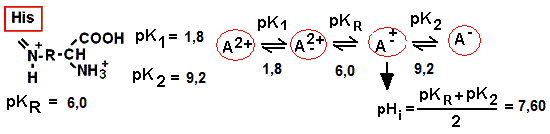
Réponse. Courbe de titration de His (suite)
Afin de dessiner la courbe de titrage, nous avons besoin des valeurs des pKas et des points d'inflexions.
Par définition toujours, le pKa est le point où la moitié de l'acide aminé dans la solution a perdu un proton, alors que l'autre moitié possède encore ce proton. Les points d'inflexion sont déterminés par la moyenne arithmétique de deux pKa consécutifs:
point d'inflexion no. 1: (1,8 + 6,0) / 2 = 3,9
point d'inflexion no. 2: ( 6,0 + 9,2) / 2 = 7,6
Le pI est défini comme étant le pH où la charge nette de l'acide aminé est neutre, et il est
déterminé par la moyenne arithmétique des pKas précédant et suivant l'espèce neutre de l'acide aminé. Pour l'histidine, le pI sera donc de 7,6

Quelle
est la charge électrique nette (+, 0, -) des des Ac. aminés suivants: glycine, sérine, acide
aspartique, glutamine et arginine, à : a) pH 2,00, b) pH 3,96, c) pH 5,68 et d) pH 10;76
Réponse:
Pour déterminer la charge électrique nette d'un acide aminé à différents pH, on doit d'abord déterminer son pI. En disposant de cette information, la charge de l'acide aminé peut être déduite à différents pH par rapport au pI. En effet, la charge de l'acide aminé à un pH égal à son pI est nulle. A un pH inférieur à son pI, l'acide aminé est chargé positivement (se comportant comme une base dans un milieu acide par rapport à son pI et donc captant un proton). Par contre, il est chargé négativement à un pH supérieur à son pI.
Ainsi, pour ce qui est de ce problème, nous obtenons les résultats suivants:

 |  |  |
Soit un mélange de lysine, glycine, alanine, isoleucine et d'acide glutamique qui sera soumis à une séparation par chromatographie échangeuse d'ions. Quel sera l'ordre d'élution des si on utilise un
tampon allant progressivement du pH 10 au pH 2 en utilisant:
a) une résine échangeuse de cations.
b) une résine échangeuse d'anions.
Quelle sera la colonne qui donne la meilleure séparation ?
Réponse
L'élution des des AA commence par pH 10. A ce pH, tous les AA du mélange seront chargés négativement (pH supérieur au pI). Les pI des acides aminés (AA) sont: Lys : 9,8, Gly : 6, Ala: 6, Ile : 6,1 et Glu : 3,2
a) sur une résine échangeuse de cations, aucun des AA ne se fixera sur la résine. Ils seront donc tous retrouvés dans l'éluant.
b) sur une résine échangeuse d'anions, tous les AA se fixent sur la résine.
Au fur et à mesure que le pH diminue, les AA sont élués dès que le pH du tampon deviendra inférieur à leur pI. Ainsi, dans l'ordre, on recueillera:
1- lysine, 2- isoleucine, alanine, glycine (tous les trois sont élués à peu près en même temps à cause de leur pI rapprochés), 3- acide glutamique.
C'est la résine échangeuse d'anions qui donnera la meilleure séparation
Liens utiles
PASSER UN CONTROLE QCM SUR L'IONISATION DES ACIDES AMINES (THEORIE + PRATIQUE)

- Biochimie structurale (Contrôle final QCM corrigé, S3 (archives 2024)
- Ac. aminés, structure et propriétés. QCM
-Ac. aminés dicarboxyliques (أحماض أمينية ثنائية الكاربوكسيل)
- Ac. aminés soufrés (أحماض أمينية مكبرتة)
- Ac. aminés à chaîne hydrocarbonnée (أحماض أمينية
بسلسلة هيدروكربونية)
- Ac. aminés hydroxylés (أحماض أمينية هيدروكسيلية)
- Ac. aminés
basiques (أحماض أمينية قاعدية)
- Ac. aminés
cycliques (أحماض أمينية حلقية)
- Ac. aminés à
amides
- Ac. aminés.
Ionisation (Exercices)
- Ac. aminés.
Structure et propriétés (QCM)
- Protéines, peptides
(contrôles)
- Ionisation des
Ac. aminés, texte Ar
- Peptides,
protéines. Exercices
- QCM métabolisme des Ac. aminés
Structure
des Protéines. Exercice
-Peptides, protéines. Exercices
- Chromatographie,
Electrophorèse. QCM
- Protéomique
Ionisation des Ac. aminés acides (cas de l'acide glutamique). Vidéo en Arabe et Français:

Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.



Chaine Youtube
(abonnement). Plusieurs vidéos multilingues

Congrès,
Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo
annonces