Acides aminés. Ionisation et titration
تأين و معايرة الأحماض الأمينية
L'ionisation (تأين) des acides aminés à des pH précis donne naissance à plusieurs formes moléculaires chrargées positivement ou négativement ou de charge électrique globale nulle.
Les courbes de titration (معايرة الأحماض الأمينية) reflètent la composition de la solution de l'acides aminé en telle ou telle forme moléculaire.
Quel est le caractère d'ionisation des a. aminés ?
Les a. aminés sont considérés comme des polyacides qui libèrent des protons H+ (H+ = H3O+) autant qu'ils présentent des groupements ionisables. Les a. aminés neutres (comme la glycine et l'alanine) ainsi que les a. aminés chargés positivement (a. aminés basiques comme la lysine et l'arginine)
et les a. aminés chargés négativement (a. aminés acides ou dicarboxyliques comme l'acide aspartique et l'acide glutamique) présentent tous des formes ioniques différentes
selon le pH des solutions.
ما هي خاصية التأين التي تمتاز بها الأحماض الأمينية؟
Quel est le caractère d'ionisation des a. aminés ?
تعتبر الأحماض الأمينية كعديدي الأحماض (polyacides) تفرز بروتوتات (H+ = H3O+)
بقدر ما لها من مجموعة تأينية (groupements ionisables). تمتاز كل من الأحماض الأمينية المتعادلة
(Acides aminés neutres، مثل الجليسين و الألنين) والأحماض الأمينية ذات الشحنة الموجبة (أحماض أمينية قاعدية كالليزين و الأرجينين) والأحماض ذات الشحنة السالبة (أحماض ثنائية الكربوكسيل أو أحماض أمينية حمضية كالحمض الأسبارتي و الحمض الجلوتامي) بأشكال تأينية مختلفة نظرا لتوفرها على اثنين أو ثلاثة مجموعات قابلة للتأين، إثر تغير حموضة الوسط. تكمن المجموعات التأينية في مجموعة الكاربوكسيل المحمولة فوق الكاربون ألفا
(a)، و هي أكثر حامضية و مجموعة الكاربوكسيل فوق الشق R (عند الحمض الكلوتامي والحمض الأسبارتي)
و مجموعة الأمين الموجودة فوق الكاربون ألفا ثم مجموعة الأمين فوق الشق R (عند الليزين
و الأرجنين، مثلا).
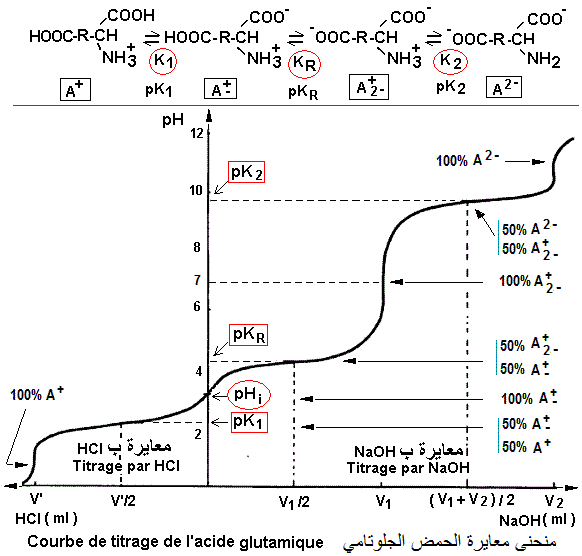
Que signifie la titration (titrage) d'un acide aminé ?
La titration (titrage) d'un acide aminé tend à montrer graphiquement les différentes formes d'ionisation de l'acide aminé et les pHauxquels elles apparaissent. Elle est réalisée de deux façon:
1/ Suivi de la dissociationde l'acide aminé (préalablement saturé par un acide) par une base. On obtient une courbe de dissociation
2/ Suivi de la saturation de l'acide aminé (préalablement dissocié par une base) par un acide. On obtient une courbe de saturation.
Ionisation des acides aminés neutres
Les a. aminés neutres se caractérisent par l'absence de toute charge électrique portée par le radical R. A une acidité élevée (pH = 1), l'acide aminé est complètement saturé de protons et porte une charge électrique positive (+). Avec l'ajout progressif d'une base (comme NaOH), le groupe carboxyle porté par le carbone alpha (a) (groupe le plus acide, pk faible), commence le premier à se dissocier et perd ainsi son proton. Ensuite, viendra le tour au groupe amine (pk plus élevé) qui perdra un proton à son tour et devient sans charge (car l'acide aminé complètement dissocié est chargé +). En fin de compte, l'acide aminé aura une charge électrique négative (-) à des pH très basiques (pH élevé, extrême)(voir le dessin suivant).
En considérant le premier équilibre (libération d'un proton par le carboxyle), la constante d'équilibre K1 peut être calculée (Constante de dissociation), qui est :
K1 = (H+) (A+)/(A+)
Pour un acide carboxylique : 10-4M<K1<10-6M
Considérant le deuxième équilibre (la perte du proton du groupe amine), il est possible de calculer la constante d'équilibre K2, qui est :
K2 = (H+) (A-)/(A+)
Pour l'amine : 10-8M<K2<10-10M
En général :
(molécule non dissociéé, acide) / (molécule dissociéé, base) (H+) = K
Le ratio de molécules dissociées et non dissociées reste lié à la concentration en protons H+ (exprimée en pH).
Si pH = 7, soit (H+) = 10-7, les constantes d'équilibre deviennent K1
et K2 comme suit :
- Cas de K1 = 10-5 M :
(A+)/(A+) = 10-5/10-7= 100,
Pour 100 molécules de base (A+)
Il existe une molécule acide (A+).
- CasK2
= 10-9 M :
(A-)/(A+) = 10-9/10-7= 1/100, par molécule de base (A-)
Il existe 100 molécules acides A+)).
Basé sur la notion de pH (logarithme). Concentration en ions hydrogène négative, pH = -log10 (H+), on en déduit :

quand le pH est équivalent à pK, la concentration de la molécule dissociée devient égale à la concentration de la molécule non dissociée. Le pH dans cette situation s'appelle 'pH de demi-dissociation'. Il exprime la force de l'acide, c.a.d la facilité avec laquelle il se débarrasse de son proton. Par exemple: pK1< pK2, signifie que l'acide 1 est plus fort que l'acide 2.
Download 'Ionisation des a. aminés neutres' (Ar, Fr).
pH isoélectrique (pI, pHi) des acides aminés
pH isoionique (pHi) des a. aminés: la dissociation des fonctions
ionisables d'un acide aminé génère des formes différentes du même acide aminé avec des charges électriques différentes. Le pH de la solution dans laquelle se trouve l'acide aminé est déterminant dans l'acquisition de charges. Le pH auquel la charge électrique globale nette est égale à zéro (coincidant avec la forme A+-) est appelé pH isoionique (pHi) ou pH isoélectrique (pI).