Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Moduler l'activité d'une enzyme pour traiter des problèmes de santé passe pa la connaissance des mécanismes d'action des inhibiteurs d'enzymes.
Le type de complexe enzyme - inhibiteur (المثبطات العكسية و تشكيل المعقد إنزيم-مثبط) qu'engage une enzyme est déterminant dans l'identification des catégories d'inhibition rencontrées (inhibiteur compétitif, inhibiteur incompétitif, inhibiteur non compétitif et inhibiteur mixte).
يتطلب تعديل نشاط الإنزيم قصد معالجة المشاكل الصحية معرفة آليات اشتغال مثبطات الإنزيمات.
يعتبر نوع المعقد الثنائي مثبط -إنزيم الذي يستخدم إنزيم حاسمًا في تحديد فئات التثبيط التي تتدخل في الأمر (تنافسية مثبط ، مثبط غير تنافسي ، مثبط غير تنافسي ومثبط مزيج)
- Fixation de l'inhibiteur sur la forme libre de l'enzyme (E)
- Fixation de l'inhibiteur sur la forme complexée de l'enzyme (ES)
- Fixation de l'inhibiteur sur la forme libre (E) et la forme complexée de l'enzyme (ES)
| French | Arabic | English |
| Inhibiteurs des enzymes | مثبطات الإنزيمات | Enzyme inhibitors |
INTERACTIONS
MOLECULAIRES ENZYME (E)-SUBSTRAT (S)-INHIBITEUR (I).
PEUT-ON BLOQUER UNE REACTION ENZYMATIQUE IN VIVO OU IN VITRO ?
Bien sûre. On peut le faire par plusieurs procédures dont
l'utilisation d'inhibiteurs (مثبطات الإنزيم)
qui peuvent être ou non des analogues structuraux des vrais
substrats de l'enzyme. Selon le type de complexe enzyme-inhibiteur
formés en présence de l'enzyme et/ou du substrat et
la modification de la cinétique qu'ils entraînent, les
inhibiteurs sont qualifiés de 'compétitifs', 'incompétitifs',
'non compétitifs' ou 'mixtes'.
En pésence d'une enzyme (E) et son substrat (S),
un inhibiteur (I) peut former des complexes binaires de type
EI ou ternaires de types ESI. Seul le complexe ES est
productif. Seul le complexe ES est productif. La définition
du mode d'action de I sur l'enzyme (effet sur Km (représentée
ici par Ks) et Vmax) et par conséquence son type dépend
des formes d'enzyme (libre (E) ou complexée au substrat (ES))
sur lesquelles il se fixera. On peut distinguer 4 cas différents:
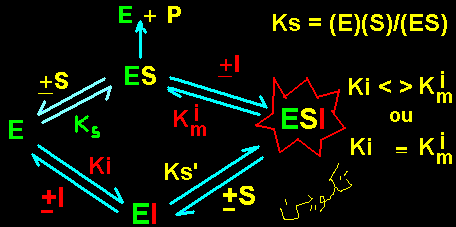
1. Fixation de l'inhibiteur sur la forme libre de l'enzyme (E)
Cette fixation aboutit àla formation d'un complexe enzyme-inhibiteur
de type binaire (EI) complétement déplaçable
en présence d'un excès de substrat (l'une des conditions de
mesure de la vitesse maximale (Vmax)). Donc, la Vmax déterminée
en présence de I ne changera pas par rapport à celle obtenue
en absence de I.
Par contre la fixaion de I sur E déplace l'équilibre E <---->
ES en faveur de E dont la concentration augmente au dépend de celle
de ES. Donc Ks (Ks = [(E)(S)]/(ES)) augmente d'un facteur [1 + (I)/KI]. Ksi
(presence de I) = Ks [1 + (I)/KI]. L'affinité de l'enzyme pour S
diminue. En considérant les effets de I sur Vmax et Ks, celui ci
sera un INHIBITEUR
COMPETITIF
2. Fixation de l'inhibiteur sur la forme d'enzyme complexée avec le substrat (ES).
Cette
fixation aboutit à la formation d'un complexe enzyme-inhibiteur-substrat
de type ternaire ESI, non complétement déplaçable
en présence d'un excès de substrat (l'une des conditions
de mesure de Vmax). Une partie de l'enzyme reste piégée
sous forme de ESI. Donc,
la Vmax sera diminuée d'un facteur [1 + (I)/KmI]. La
vitesse maximale de la réaction en présence de I (Vmax')
= Vmax/[1 + (I)/KmI].
La fixation de I sur ES déplace l'équilibre E <---> ES en faveur de ES dont la concentration augmente. Donc Ks diminue d'un facteur [1 + (I)/KmI]. En présence de I, Ksi = Ks/[1 + (I)/KmI]. L'affinité de l'enzyme pour son substrat augmente. En considérant les effets de I sur Vmax et Ks, celui ci sera un INIBITEUR INCOMPETITIF
3. Fixation de l'inhibiteur avec des affinités différentes sur les formes libre (E) et complexée (ES) de l'enzyme (KI><KmI).
Cette
fixation aboutit à la formation d'un complexe ternaire (ESI) non productif et non complètement déplaçable
par excès de substrat (l'une des condition de mesure de Vmax). Une partie de l'enzyme reste piegée par l'inhibiteur. La
Vmax diminue d'un facteur [1 + (I)/KmI]. Donc, en présence de I, Vmax' = Vmax/[1 + (I)/KmI].
L'inhibiteur se fixe sur E et ES. La fixation de I sur E entraine une augmentation de Ks (comme démontré dans l'inhibition compétitive, ci dessus). En présence de I, Ksi = Ks [1 + (I)/KI]. Par contre, la fixation de I sur ES fait diminuer Ks (comme démontré dans l'inhibition incompétitive ci dessus). En présence de I, Ksi = Ks/[1 + (I)/KmI]. En tout:
Ksi = Ks [1 + (I)/Ki]/[1 + (I)/KmI]. Le paramètre Ks change.
Sa variation dépend du rapport [1 + (I)/KI]/[1 + (I)/KmI].
L'inhibiteur en question est un INHIBITEUR MIXTE
4. Fixation de l'inhibiteur avec les mêmes affinités sur les formes libre (E) et complexée (ES) de l'enzyme (Ki = Ki').
Comme dans le cas de l'inhibiteur mixte, Vmax diminue d'un facteur égal à [1 + (I)/KI]. Comme KI = KmI, le paramètre Ks ne change pas. Il reste constant car le rapport [1+(I)/KI]/[1+(I)/KmI] devient égal à 1. L'inhibiteur en question est un INHIBITEUR NON COMPETITIF.
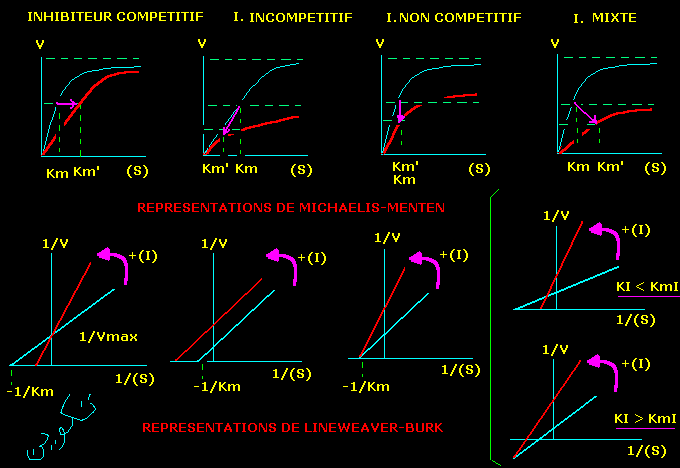
5. Comparaison des inhibiteurs réversibles
Représentations graphiques
PASSER UN CONTROLE NOTE ET COMMENTE SUR L'ENZYMOLOGIE

-
Enzymologie-enzymes (exercices)
- QCM-Enzymes. Structure et fonction
(bases)
- Hexokinase
- Coenzyme Atransférase
- Amine oxydase
- Inhibiteurs. Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Phospholipase, Allostérie
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase.
Examen S5
- Phospholipase A2.Examen
Enzymologie. E-books
- Livre 'Sciences de la vie. Protéines et Enzymes', Baaziz 2013:

306 pages, 2013, ISBN : 978-99-54-32-663-3 + DVD mis à jour 2018 + Assistance
- Livre 'Structures et Métabolisme des Sucres', Baaziz, 2018(+ DVD, 400 QCM):

- Présentation du livre
- Afiche annonce du livre
Actions
takween pour la promotion de la culture scientifique et la réussite de la transition Lycée-Université
تكوين. دعم الثقافة العلمية و مواكبة الانتقال
من الثانوية إلى الجامعة
Afin de pouvoir
continuer à servir les visiteurs, soutenez nos actions sur le site
takween en faisant acquisition des ouvrages et supports pédagogiques
desitinés à améliorer l'enseignement et la recherche
scientfique en Biochimie.

Chaine Youtube (abonnement).
Plusieurs vidéos multilingues
- تحميل ملفات في مواضيع البيوكيمياء Téléchargement de fichiers en Biochimie

- آفاق الدراسات بكليات العلوم و رد الاعتبار لمؤسسات ا لتعليم العالي ذات الاستقطاب المفتوح
- Congrès,Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo. annonces