La purification des protéines implique plusieurs techniques dans la chromatographie (DEAE-cellulose, CM-cellulose), la précipitation par les sels, l'électrophorèse, la centrifugation...
| عربي | English | Français |
| تنقية البروتينات | Protein purification | Purification des protéines |
|
كروماتوغرافيا
|
Chromatography | Chromatographie |
Question 1.
Quelles sont les raisons d'utilisation de la précipitation au sulfate d'ammonium comme étape initiale de purification d'une protéine?
(Réponse 1)
Question 2. Un mélange de protéines contenant l'ovalbumine (pI 4,6), uréase (pI 5,0), et myoblobine (pI 7,0) est séparé
par chromatographie sur une colonne de DEAE-cellulose à pH 6,5.
La colonne a été éluée à pH 6.5 avec un tampon de force ionique faible, puis avec le même tampon contenant
des concentrations croissantes de chlorure de sodium (NaCl). Déterminer
l'ordre d'élution des des différentes protéines (Réponse
2)
Question 3.
Expliquer l'utilisation rare d'une chromatographie DEAE-cellulose à un pH supérieur
à 8,5
(Réponse
3)
Question 4.
Justifier le choix d'utilisation de tampons à pH supérieur à 6,0 mais inférieur à 9,0 lors
de la chromatographie sur DEAE-cellulose de la 6-phosphogluconate déshydrogénase qui possède un pI
de 6 (marge de pH permettant la fixation de l'enzyme).
(Réponse 4).
Question 5.
Concernant la purification de l'enzyme 6-phosphogluconate déshydrogénase:
a) L'enzyme pourra-t-elle se lier à une résine de CM-cellulose
si on utilise des tampons à pH supérieur à 6,0 mais inférieur à 9,0 ? Justifier votre réponse ?
b) Quel pH approximatif le tampon devra-t-il avoir pour permettre à l'enzyme d'être fixée sur la colonne de CM-cellulose?
(Réponse 5).
Proposer un protocole de purification d'une enzyme de poids moléculaire 24
kDa et de pI 5.5 et qui est contaminée par deux autres protéines, l'une de masse moléculaire analogue et de pI 7.0, et l'autre de poids
100 kDa et de pI 5.4.
(Réponse
6).
(adapté de Eric R. Gauthier, 2007). Un protocole de purification d'une enzyme E d'E. coli comprend
les étapes ci-dessous.
a) Calculez pour chaque étape (1) l'activité spécifique,
(2) le pourcentage de rendement par rapport à la quantité initiale d'enzyme et (3) le degré de purification (x fois).
b) Indiquez quelle étape permet la plus grande purification
de la protéine.
c) Considérant que la protéine est pure après le tamisage moléculaire (Bio-Gel A), quel pourcentage de l'extrait
initial était constitué de l'enzyme E?
| étape
de purification |
Volume (mL) | Protéines totales (mg) |
Activite enzymatique (microg./min) |
| 1- Extrait cellulaire | 2800 | 70000 | 2700 |
| 2- Sulfate d'ammonium | 3 000 | 25400 | 2300 |
| 3- Dénaturation chaleur | 3000 | 16500 | 1980 |
| 4- Chromato. DEAE | 80,00 | 390,00 | 1680 |
| 5- CM-cellulose | 50,00 | 47,00 | 1350 |
| 6- Bio-Gel A | 7,0 | 35,00 | 1120 |
(Réponse 7).
Réponse pour Q1
(Question 1)
La précipitation au sulfate d'ammonium (fractionnement par le sulfate
d'ammonium, relargage) exploite le critère de la solubilité des protéines. Elle permet de concentrer la protéine d'intérêt en précipitant de manière non-spécifique une proportion
généralement importante des protéines contenues dans
l'extrait total. On obtient un extrait brut (purification partielle) de
la protéine, qui peut ensuite subir d'autres étapes de purification.
Réponses. Détails (suite)
Réponse pour Q2
(Question 2)
Afin d'éluer des protéines liées sur une résine
échangeuse d'ions, deux possibilités sont offertes:
1/ utiliser un gradient de pH ou de sel (généralement du
NaCl). Dans la cas où on opte pour l'utilisation d'un gradient
de NaCl, on débute généralement avec un tampon de
faible force ionique, suivi par une série de tampons dont la concentration
en NaCl augmente graduellement (on peut utiliser un formeur de gradient continu). Les ions Na+ ou Cl- décrochent les protéines de la colonne en neutralisant les charges négatives ou positives qui
permettent aux protéines d'interagir avec la résine. Le
résultat est l'élution des protéines selon leur densité
de charge. En effet, pour être décrochées d'une colonne
échangeuse de cations (CM-cellulose), les
protéines possédant moins de charges positive nécessiteront
moins d'ions Cl- (donc une concentration de NaCl moins élevée)
pour neutraliser leurs charges que des protéines possédant
plus de charges positives.
La même logique s'applique aux ions Na+ lors de l'élution de protéines
fixées à une résine échangeuse d'anions (DEAE-cellulose).

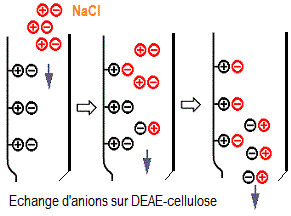

Dans
le cas de cet exercice, on peut conclure que :
- la myoglobine sera éluée la première, car elle
ne se fixera pas à la colonne (pH<pI: donc charge nette positive)
- le pI de l'uréase (5,4) est plus rapproché du pH du tampon
que le pI de l'ovalbumine (4,6): l'uréase possédera donc
une charge globale nette moins négative que l'ovalbumine. On peut
donc prédire que l'uréase sera éluée à
une concentration de NaCl inférieure à celle requise pour
éluer l'ovalbumine.
L'ordre d'élution sera donc: 1: myoglobine (non retenue
par la résine), 2: uréase et 3: ovalbumine.
Réponse pour Q3
(Question 3)
Le groupe diéthylamino (-CH2-CH2-NH+-CH2-CH3) du DEAE-cellulose porte une charge positive qui est à la base du fonctionnement de cette colonne. En effet, les acides aminés/protéines chargées négativement vont se lier (via des liaisons électrostatiques) au groupe diéthylamino, alors que les acides aminés/protéines
chargés positivement se retrouveront dans l'éluant. Comme le groupe diéthylamino possède un pKa voisin de 8,5,
ce groupe sera déprotoné à un pH supérieur à 8,5, ce qui lui enlève toute sa capacité à lier des substances chargées négativement.
Réponse pour Q4
(Question 4)
A un pH supérieur à 6 (pI de la 6-phosphogluconate
déshydrogénase), cette enzyme possède une charge globale négative (pH>pI). Elle peut se fixer sur la colonne DEAE-Cellulose. A un pH supérieur à 9, le groupe
diéthylamino de la colonne perd son proton, empêchant en
même temps toute séparation de l'enzyme selon sa charge.

 |
 |  |
| étape de purification |
Activité
spécifique (U/mg) |
Rendement (%) | Degré
de purification (n fois) |
| 1- Extrait cellulaire | 0,039 (= 2700/70000) | 100 | 1 |
| 2- Sulfate d'ammonium | 0,090 (= 2300/25400) | 85,20 (= 2300/2700) x 100 | 2,30 (= 0,09/0,039) |
| 3- Dénaturation chaleur | 0,12 | 73,30 | 3,07 |
| 4- Chromato. DEAE | 4,31 | 62,20 | 110,50 |
| 5- CM-cellulose | 28,72 | 50,00 | 736,40 |
| 6- Bio-Gel A | 32,0 (= 1120/35) | 41,50 (= 1120/2700) x 100 | 820,50 (= 32/0,039) |
b)
Afin de déterminer quelle étape fut la plus efficace dans
la purification de l'enzyme, il s'agit de diviser le degré de purification
après une étape x par le degré de purification de
l'étape précédente. Ainsi, l'étape de chromatographie
sur DEAE a permis la plus grande purification de l'enzyme, soit 36
fois (= 110,5/3;07).
Conclusion
sur le protocole de purification suivi dans la purification de l'enzyme
E: Ce protocole (constitué de 6 étapes) permet de purifier
l'enzyme 820,5 fois en gardant 41,5% de l'enzyme de départ (c.a.d
perte de 58,5% de l'enzyme de départ).
c) Considérant que la protéine est pure après tamisage
moléculaire, on aura donc recueilli 35 mg de l'enzyme E. Ceci correspond à 41,5 % de la quantité
d'enzyme présente initialement dans l'extrait (rendement). Ainsi,
dans notre extrait initial, on avait: 35 mg / 41,5% = 75,9 mg
Et cette quantité d'enzyme était initialement présente
dans 70000 mg de protéine. On avait doncdans l'extrait brut: (75,9 mg / 70 000 mg) x 100 = 0,108 % de l'enzyme E
- Biochimie structurale (Contrôle final QCM corrigé, S3 (archives 2024)
- Acides aminés. Exercices
- Structure des Protéines. Exercice
- Peptides, protéines. Exercices
- Chromatographie, Electrophorèse. QCM
- Equilibre Acide-base. Exercices
- الإنزيمات. تنقية وتطبيقات
Enzymes. Purification and applications
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
