Les étapes principale de la protéomiques sont:
1. Extraction des protéines et préparation des échantillons (extraction des protéines).
2. Séparation des protéines (électrophorèse bidimensionnelle, Chromatographie liquide).
3. Détection et quantification des protéines et 4. Identification des protéines par spectrométrie de masse.
- Le protéome est l'ensemble des protéines produites par un génôme (ordre de 60000 protéines chez l'Homme).
- Le protéome résulte de la traduction du génôme en protéines dans des conditions de vie définies. Il varie selon le type des cellules, leurs activités et leur environnement.
- La taille du protéome est plus importante que celle du génôme, car un gène peut coder pour plusieurs protéines en considérant les modifications introduites par la maturation des mRNA et les modifications post-traductionnelles (glycosylation, phosphorylation,...). Le protéome est dynamique, le génome est constant.
Extraction des protéines et préparation des échantillons
- Séparation des protéines (électrophorèse bidimensionnelle, Chromatographie liquide)
- Détection et quantification des protéines
- Identification des protéines par spectrométrie de masse
2.1. Extraction des protéines et préparation des échantillons
La protéomique exige l'utilisations d'échantillons biologiques de qualité. L'extraction de protéines à partir de tissus, de cellules isolées ou de liquides physiologiques est réalisée à l'aide de tampons appropriés, mis au point en considérant la nature des protéines à étudier (protéines cytosoliques, membranaires, nucléaires…).
Les tampons d'extraction à pH bien déterminé, sont constitués dans des proportions variables, de mélanges
d'agents réducteurs, de détergents, voire de solvants organiques. Ils sont généralement supplémentés d'inhibiteurs de protéases. Les protocoles experimentaux doivent éviter les contaminations par des acides nucléiques, des lipides et les sels.
Ces contaminants peuvent perturber la séparation des protéines par électrophorèse bidimensionnelle ou par chromatographie liquide. Les protéines hydrophobes telles que les protéines membranaires sont difficiles à solubiliser. De même, les protéines très basiques, telles que les histones et les protéines ribosomales, sont peu visibles sur un gel 2D après une isoélectrofocalisation.
De façon générale, la protéomique fait
appel à l'utilisation de l'électrophorèse
bidimensionnelle (2D) hautement résolutive et la spectrométrie
de masse qui associée à l'analyse informatisée des gels, permet de visualiser et de mesurer des variations de quantité de protéines entre différents échantillons. Les protéines identifiées par spectrométrie de masse sont comparées aux protéines des banques de données disponibles sur internet.
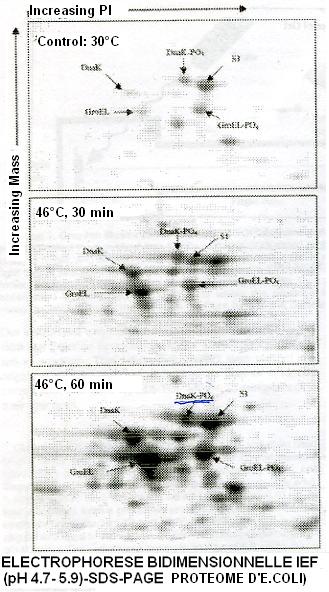
2.2. Séparation des protéines par électrophorèse bidimensionnelle (2D)
L'électrophorèse 2D est la méthode de choix pour séparer les protéines puisqu'elle permet de séparer simultanément plusieurs milliers de polypeptides d'un mélange complexe en fonction
de deux propriétés différentes : la charge éléctrique et le poids moléculaire.
Dans la première dimension, les protéines sont soumises à une électrophorèse dans un gel présentant un gradient de pH continu. Au cours de cette étape, appelée isoélectrofocalisation (IEF), elles migrent dans le gel jusqu'à une position où la valeur du pH est égale à celle de leur point isoélectrique (pI) où leur charge globale devient nulle. Cette première séparation est délicate et dépend beaucoup de la préparation des échantillons biologiques qui doit permettre une solubilisation maximale des protéines et empêcher leur agrégation et leur dégradation. Dans la deuxième dimension, les protéines sont séparées par la technique SDS-Page (sodium-dodécyl sulfate-polyacrylamide gel electrophoresis). La résolution s'effectue sur un gel réticulé constitué de polyacrylamide en présence d'un agent dénaturant, le sodium-dodécyl sulfate (SDS).

Grâce à la réticulation plus ou moins importante du gel de polyacrylamide, les protéines sont séparées par
tamisage moléculaire, leur vitesse de migration dans le gel étant inversement corrélée à leur taille. Comme pour l'IEF, plus le gel de deuxième dimension est grand, plus la résolution (et donc le nombre de spots séparés) augmente.
2.3. Détection et quantification des protéines
Après électrophorèse bidimensionnelle, les protéines séparées sont détectées par coloration des gels. Plusieurs procédés de sensibilité différente existent et sont choisis en fonction de l'utilisation ultérieure des gels 2D : le bleu de coomassie permet de détecter un minimum de 100 ng de protéine par spot et présente l'avantage de donner une intensité de coloration proportionnelle à la quantité de protéines. Etant mille fois plus sensible que le bleu de coomassie, la coloration au nitrate
d'argent permet de détecter des spots contenant 0,1 ng de protéines. Elle présente néanmoins certains
inconvénients : la stœchiométrie de la coloration n'est pas totalement linéaire, la reproductibilité est difficile à obtenir et certaines protéines sont peu ou pas colorées par cette méthode. Plus récemment,
la détection des spots par fluorescence (Sypro Orange, Sypro Red, Sypro Ruby) a été développée,
avec une sensibilité et une linéarité d'intensité de coloration équivalente à celle de l'argent, mais avec une reproductibilité, une facilité et une rapidité meilleures que celles de la coloration au nitrate d'argent.
En dernier lieu, notons que l'autoradiographie des gels 2D après incorporation dans les protéines d'isotopes radioactifs comme le 35S ou le 32P/33P est extrêmement sensible. En effet, elle permet de visualiser des quantités très faibles de protéines (de l'ordre de 1 à 100 pg).
Depuis les années 1970, les méthodes d'analyse des gels ont évolué grâce aux progrès combinés
de l'informatique et de l'analyse d'images. La digitalisation des gels consiste en une transformation de l'image expérimentale en une information numérique utilisable par l'ordinateur.
Les gels 2D peuvent être comparés aux gels inscrits dans les bases de données comme celle de SWISS-2-DPAGE (SWISS-2-DPAGE)
Share this information on social mediaالإجتماعية
تبادل المعلومة عبر المواقع الإجتماعية الإجتماعية
 |
 |
 |
 |
 |
Spectrométrie de masse et recherche dans les banques de données
L'avancée majeure en termes d'identification des protéines des gels 2D (1993-1994) correspond à l'utilisation conjointe de la spectrométrie de masse et des banques de données. En s'adaptant
à la biologie structurale, la spectrométrie de masse
a permis de déterminer avec une sensibilité et une précision
extrêmes la masse des molécules. Un spectromètre
de masse se compose d'une source où s'effectuent l'ionisation
et la désorption des ions, d'un analyseur où les ions
sont séparés en fonction de leur rapport masse sur
charge (m/z) et d'un détecteur permettant l'enregistrement
et la quantification des ions.
Pour l'étude des composés peptidiques, deux modes d'ionisation sont principalement utilisés :
- la désorption/ionisation laser assistée par matrice
(Maldi-Tof) qui permet de réaliser une empreinte peptidique
après digestion protéolytique (empreintes peptidiques)
- la spectrométrie de masse en tandem en mode nanospray (MS-MS)
qui permet d'obtenir une microséquence en acides aminés.
LIENS UTILES
Bases de données disponibles sur internet:
- Mascot: MASCOT
- Aldente : Aldente
Autres liens
- Spectromètre de masse: Spectromètre de masse
- PROTEOMIQUE. TD
- Protéomique. Examen
- Protéomique. TP-TD

360 pages, 2018, ISBN : 978-9920-35-345-8 + DVD mis à jour + Assistance.

Comment avoir ces livres ? - أين يمكن اقتناء الكتب؟
Chaine
Youtube (abonnement). Vidéos multilingues

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.