Le critère de la taille des molécules donne lieu aux techniques de chromatographie exclusion ou perméation (gel exclusion chromatography, كروماتوغرافيا الإقصاء، كروماتوغرافيا التغلغل)
La
chromatographie de perméation, souvent appelée chromatographie d'exclusion (gel exclusion chromatography, كروماتوغرافيا الإقصاء، كروماتوغرافيا التغلغل), ou filtration sur gel ou tamisage moléculaire, est une technique de séparation basée sur le critère de la taille des molécules.
تعتمد كروماتوغرافيا الإقصاء خاصية الحجم (الوزن) في عزل الجزيئات
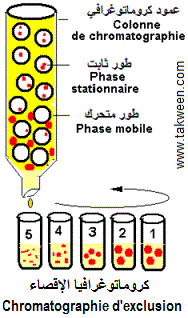
Ne pouvant rentrer dans les mailles du gel, les molécules de taille élevée franchissenet rapidement le support et sont collectées les premières, contrairement
aux petites molécules qui rentrent dans les mailles du
gel est sont freinées dans leur parcours et récupérées
dans les derniers tubes (voir figure suivante).
La
filtration sur gel sépare les molécules selon leur taille, particulièrement selon leur rayon de Stokes. Néanmoins, les relations entre le rayon de Stokes, la taille et la masse sont
affectées par plusieurs facteurs dont la géométrie de la molécule. En effet une protéine fibrillaire (allongée) et une protéine globulaire de même
masse ne se comporteront pas de la même façon dans un gel. Aussi, la glycosylation d'une protéine altère fortement la géométrie. C'est pour cette raison que
la masse des protéines glycosylées est souvent surestimée.
De même, la présence de sels, de détergents, d'agents
chaotropiques, etc., peut aussi modifier le comportement d'une protéine
dans une filtration sur gel. Le choix des tampons n'affecte pas la
résolution. Cependant, une faible concentration de sel entre
25 mM et 150 mM en NaCl peut être utilisée pour
réduire les interactions ioniques non spécifiques entre
les protéines et les gels. A des forces ioniques très
faibles, la présence de faibles charges négatives sur
les gels peut causer un retard dans la migration des protéines
basiques. La chromatographie d'exclusion est utilisée comme
une méthode d'échange de tampon plus rapide et
plus fiable que la dialyse, car elle est compatible avec plusieurs
solvants et nécessite moins de tampon.
Un gel de filtration déterminé présente a un domaine
de fractionnement (Fractionation Range) spécifique (exprimé
en termes de masse moléculaire) à l'intérieur duquel les protéines vont prendre, pour sortir du gel, un temps proportionnel à leur taille, donc à leur poids. à
l'intérieur de cette marge, les molécules peuvent être
séparées les unes des autres. Les molécules de
taille dépassant la limite supérieure de fractionnement
(limite d'exclusion) vont sortir ensemble, assez rapidement. De même,
les molécules plus petites que la limite inférieure
de fractionnement sortiront ensemble tardivement. Dans ces deux
cas il est impossible de séparer les molécules selon
leur masse. Seules, les molécules ayant
une masse entre ces deux limites pourront donc être séparées
les unes des autres. Ces limites sont appelées domaine
de fractionnement. Il existe plusieurs types de résine ayant
des domaines de fractionnement différents. Elles sont vendues
par plusieurs fabricants dont 'Sephadex' et 'Bio-Gel'. Il existe deux grands types
d'applications de la filtration sur gel dont la séparation
de groupe (séparation grossière) et le fractionnement
moléculaire (séparation fine).
La séparation de groupe consiste à séparer les petites molécules des grosses, en deux groupes distincts où les grosses molécules sortent dans le volume mort et les autres sont éluées tardivement. Ainsi, la filtration sur gel ( chromatographie d'exclusion) peut servir au 'dessalage' de solutions (élimination des sels, sucres, acides aminés, etc. Dans ce cas on utilise une résine ayant un domaine de fractionnement petit où toutes les protéines iront dans le volume mort tandis que les sels et autres petites molécules pourront entrer dans les pores du gel. A l'échelle industrielle, on peut produire du lait sans lactose, pour les personnes intolérantes au lactose, en dessalant le lait. Dans ce cas on utilise des colonnes de taille industrielle. Pour le dessalage, on peut utiliser des colonnes plus courtes. Les volumes d'échantillon peuvent aller jusqu'à 10 à 20% du lit de la colonne. Le lit du gel occupe ce qu'on appelle le volume total du gel (qui comprend le liquide à l'extérieur des billes et celui des billes.
'For group separation use volumes up to 30% of the total column volume. A sample volume of 0.5% to 4% of total volume is recommended. For most applications the sample volume should not exceed 2% to achieve maximum resolution. The ratio of sample volume to column influences: The higher the ratio the lower the resolution
Share this information on social media
تبادل المعلومة عبر المواقع الإجتماعية




Séparation par Fractionnement moléculaire
Le fractionnement moléculaire permet de séparer un mélange complexe (protéines, par exemple) en plusieurs fractions de poids moléculaire spécifique. Le but de cette opération est la détermination de la masse moléculaire des protéines (application analytique). On peut se servir du fractionnement moléculaire pour purifier une protéine donnée (application préparative). La chromatographie d'exclusion permet la séparation des espèces moléculaires similaires (par exemple, les formes tronquées et oligomères) qui pourraient ne pas être séparées avec d'autres techniques de purification. Les filtrations sur gel constituent souvent la dernière étape d'une purification de protéines car, nécessitant une préparation relativement avancée à petit volume, pour être efficaces. Le lit de la colonne doit être relativement long pour une meilleure purification. (par exemple, une colonne de hauteur de l'ordre de 100 cm avec 1 à 2 cm de diamètre). Dans ces conditions, le débit est lent. L'échantillon doit être de volume minime. Il est généralement de l'ordre de 1% de celui du lit de la colonne. Plus le rapport Volume de l'échantillon/volume de la colonne est élevé, plus la résolution est faible.
| Type de gel Sephadex | Domaine de fractionnement (Da) | Applications |
|
G-10 |
700 |
Dessalage de peptides. G-10 is suitable for the separation of biomolecules such as peptides (MW>700 Da) from smaller molecules (MW <100 Da). |
| G-25 | 1000-5000 | Dessalage de protéines et acides nucléiques. G-25 is recommended for the majority of group separations involving globular proteins. These media are excellent for removing salt and other small contaminants away from molecules that are greater than MW 5000 Da. The particle size determines the flow rates and the maximum sample volumes that can be applied. Smaller particles give higher column efficiency (narrow, symmetrical peaks), but may need to be run more slowly as they create higher operating pressures |
| G-50 |
1500-30000 |
G-50 separates molecules of MW >30000 Da from molecules MW <1 500 Da such as labeled protein or DNA from unconjugated dyes. The medium is often used to remove small nucleotides from longer chain nucleic acids. |
| G-75 | 3000-80000 | |
| G-100 | 4000-150000 | Détermination des poids moléculaires. G-100 is recommended for molecular weight determination |
| G-150 G-200 |
5000-300000 5000-600000 |
Les
colonnes de Sephadex Sephadex G restent stables dans l'intervalle de pH 3–12, pouvant contenir des additifs comme les détergents (1% SDS), agents dénaturants (8 M urée ou 6 M guanidine hydrochloride).
Conditions augmentant la résolution des protéines par chromatographie d'exclusion:
1. Veiller à ce que la viscosité de l'échantillon
et des solvants soient similaires (ajuster les conditions de l'échantillon
pour correspondre approximativement à celle du tampon).
2. Ajouter du sel (NaCl) dans le tampon. Une petite quantité de
sel aidera à prévenir les interactions non spécifiques
entre la protéine et la phase stationnaire.
3. Réduire au minimum le volume de l'échantillon. Plus
le volume est faible, moins diffuses seront les fractions éluées.
4. Utiliser une colonne de longueur adaptée. Une colonne trop
courte ne permet pas la séparation adéquate des protéines.
Alors qu'une colonne trop longue conduit à la diffusion de
l'échantillon de protéines.
5. Remplissage adéquat de la colonne. La préparation de
la colonne influence la résolution des protéines.
6. Régler le débit (débit modéré).
Un débit trop rapide ne permet pas aux petites molécules
de pénétrer dans les pores de la matrice. Un débit
trop entraine la diffusion de l'échantillon.
- Chromatographie sur papier
- Chromato sur couche mince (CCM)
- Polarité
- Taille
- Chromatographie d'échange d'ions (ion exchange chromatography, كروماتوغرافيا التبادل الإيوني)
- Chromato d'affinité (Affinity chromatography, كروماتوغرافيا الألفة)
- Chromatographie d'interactions hydrophobes (hydrophobic interaction chromatography, كروماتوغرافياالتفاعل الهيدروفوبي)
- Séparation des protéines (chromatographie, ..). Exercices
- Chromatographie, Electrophorèse. QCM
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
