
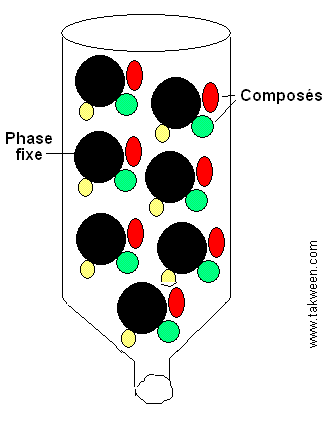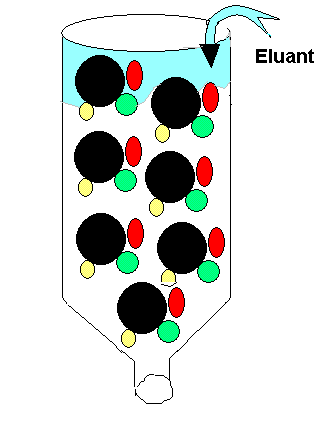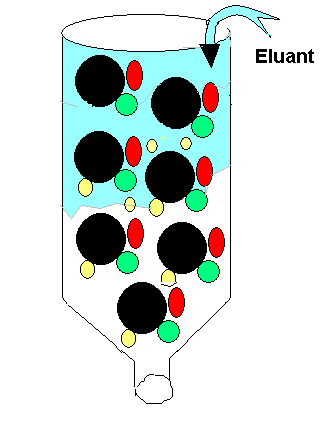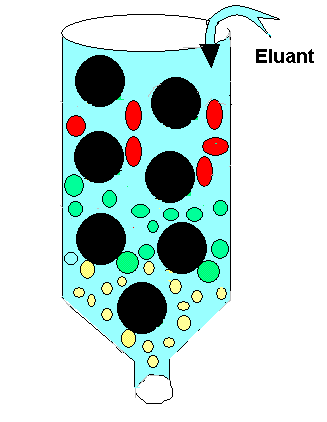
Après leur extraction, les protéines sont analysées par des techniques de séparation variées dont la chromatographie et l'électrophorèse (cas des albumines et globulines sériques).
QUESTION1. Parmi les propsitions suivantes, lesquelles sont fausses? (Réponse 1)
(le pI est la valeur de pH pour laquelle une protéine
n'a pas de charge)(!à une valeur de pH
égale à son pI, une protéine ne migre pas dans un champs électrique au cours d'une électrophorèse)(une protéine acide aura un pI plus grand que 7,0)(!une protéine basique aura un pI plus grand que 7,0)
QUESTION 2.Les 5 protéines dont les masses moléculaires et les points isoélectriques sont donnés ci-dessous, sont séparées
par électrophorèse sur gel de polyacrylamide (une des techniques de séparation très utilisée) en présence de SDS. Donner l'ordre de leur migration du sommet
(le point de dépôt des échantillons) à la partie inférieure du gel.
a: alpha-Antitrypsine (PM: 45000, pI: 5,4),
b: Cytochrom c (PM: 13400, pI: 10,6),
c: Myoglobine (PM: 17000, pI: 7,0),
d: Albumine sérique (PM: 69000, pI: 4,8),
e: Transferrine (PM: 90000, pI: 5,9).(Réponse
2)
(!a-b-c-d-e)(!d-a-e-c-b)(e-d-a-c-b)(!b-c-a-d-e)(!b-c-e-a-d)
QUESTION 3. Si les 5 protéines de la question 2 sont séparées par isoélectrofocalisation, quelle pourrait être leur distribution ordonnée de l'extrémité négative (cathode, -) à l'extrémité positive (anode,+) du gel ? Donner les valeurs du le plus hautes et les plus faibles
de pH. (Réponse 3)
(!a-d-c-b-e)(b-c-e-a-d)(!d-a-e-c-b)(!e-d-a-c-b)(!b-c-a-d-e)
QUESTION 4. Parmi les techniques suivantes, quelles sont celles qui partagent la charge électrique comme critère dans la séparation des molécules ?(Réponse 4)
- a: électrophorèse
- b: Chromatographie d'exclusion (ge-filtration)
- c: Relargage par sels (salting out)
- d: Immunoprecipitation
- e: Isoélectrofocalisation
- f: Chromatographie d'affinité
- g: Chromatographie d'échange d'ions
- h: Ultracentrifugation de zone.
(!a-b-c)(!e-g-f)(!b-h-g)(!d-e-g)(a-e-g)
QUESTION 5.Parmi
les techniques de séparation et d'analyse suivantes préciser celles qui sont utilisées pour localiser les ponts dissulfure dans une protéine:(Réponse
5):
(!Réduction préalable suivie de carboxyméthylation de la protéine)(!clivage de la protéine par hydrolyse acide)(CClivage spécifique
maintenant les ponts dissulfure intacts)(!séparation
par électrophorèse sur gel de polyacrylamide-SDS des différents peptides)(Séparation des peptides par électrophorèse bidimensionnelle,
un traitement par acide performique s'intercalant entre la 1ere. et la 2eme. dimension.)
QUESTION 6. Un mélange d'acides aminés est séparé par chromatographie de partage à pH 6,0. Choisir parmi les intérprétations suivantes, celle qui sont vraies (Réponse 6): ( Val migre plus loin que Ser)(Gln migre plus loin que Asn)(Phe migre plus loin que Val)(! Lys migre plus loin que Ileu)(! Asp migre plus loin que Ala)
Question 7
La séparation des peptides P (Lys-Gly-Ala-Gly), Q (Lys-Gly-Ala-Glu) et R (His-Gly-Ala-Glu) a été effectuée par électrophorèse sur papier réalisée à différents pH. Quelle serait la direction de migration (A: vers l'anode, C: vers cahode et O: immobile) pour ces peptides aux valeurs de pH données: (Réponse 7)
a: pH=2,0
a: pH=4,0
a: pH=6,0
a: pH=11,0
Question 8
Protéines. Q8
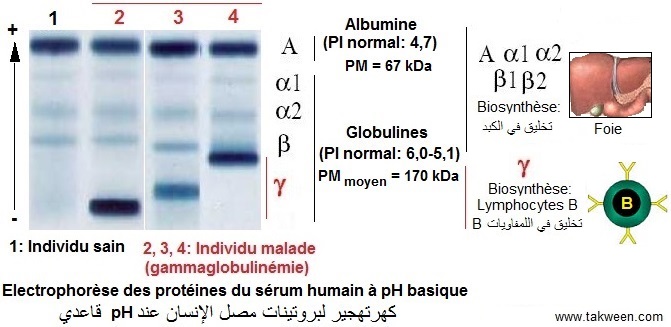
(Réponse 8). L'électrophorèse des protéines du sérum
d'un individu sain et d'un individu malade (infection bactérienne
ou virale (VIH, hépatite), autoimmunité) a été réalisée à pH très basique (pH 8-9). L'électrophorégramme est représenté par la figure ci dessous. Expliquer le
principe de la séparation par électrophorèse
des globulines et de l'albumine dans les deux situations différentes.

-
Alpha 1-globulines: a1-lipoprotéine
(ex: HDL (= 'bon cholestérol') de
PM: 390 kDa), a1-antitrypsine (PM: 55 kDa), a1-antichymotrypsine,
transcortine (PM: 49,5 kDa), orosomucoïde (a1-glycoprotéine
acide, 40 kDa), globuline liant la thyroxine, prothrombine. La protéine
majeure est l'alpha 1-antitrypsine.
- Alpha 2-globulines: a2-macroglobuline (glycoprotéine,
PM: 850 kDa), haptoglobine (très riche en glucides,
PM: 86-160 kDa pour formes monomériques), céruléoplasmine
(a2-glycoprotéine, PM: 150 kDa),
Choline-estérase, plasminogène, antithrombine III, protéine
liant le rétinol et protéine liant la vitamine D. La protéine
majeure est l'alpha 2-macroglobuline.
- Béta-globulines: bêta-lipoprotéine
(LDL de PM 2500 kDa), transferrine (PM: 90 kDa), hémopexine (glycoprotéine, PM: 80 kDa), facteur C3 du complément (PM: 200 kDa), ß
2-microglobuline, fibrinogène (peut être dans la zone gamma, aussi), globuline liant les stéroïdes sexuels, transcobalamine, Protéine C réactive (en interzone Béta-Gamma, CRP).
Les protéines majeures sont la béta-lipoprotéines (LDL = 'mauvais cholestérol'), le facteur C3 du complément et la transferrine.
- Poids moléculaires des gammaglobulines (immunoglobulines, Ig): variable selon le types des Ig.
Exemples IgG (85% des ig sériques): 150 kDa, IgA: 160-400 kDa et IgM: 900 kDa (+ IgD: 185 kDa et IgE: 190
kD). Cette zone contient aussi, le lysozyme, le fibrinogène et
la protéine C-réactive.
Protéines Q1 (Question 1).
a, c. Quel que soit le pH, une protéine n'est jamais dépourvue de charge électrique. A son pI,
la somme de toutes les charges est égale à zéro.
Une protéine acide aura un pI plus petit que 7,0 au lieu de plus grand que 7,0

Protéines Q2 (Question 2.)
Sommet: e, d, a, c, b partie inférieure. La séparation est réalisée en fonction de la taille des molécules
(PM)
Protéines Q3
(Question 3)
.
pH élevé (-) b, c, e, a, d pH faible (+).
L'isoélectrofocalisation (IEF) sépare les protéines en fonction de leurs valeurs de PI.
- A
pH 6,0, la charge nette est 0 due à une charge +2 apportée par le résidu Lys et une charge -2 apportée par le résidu Glu.
- A pH 11,0, le groupement alpha-aminé est déprotoné (charge 0) et la chaîne latérale Lys est à demi-protonée (charge +0,5); la charge nette est donc de -1,5.
Protéines
Q4(Question 4)
a: Taille, Charge, b: Taille, c: Solubilité,
Charge, d: Liaison spécifique, e: Charge, f: Liaison
spécifique, g: charge, h: taille.
Protéines Q5
(Question 5). Un pont disulfure (pont S-S) est une liaison covalente qui se forme par oxydation dans les protéines, de manière post-traductionnelle. Le cytoplasme n'étant pas un milieu oxydant, il y a trés peu de protéines intracellulaires qui possèdent des ponts disulfure.
Réponses: c, e. L'acide performique oxyde les liaisons disulfure en groupement SO(3-) et libère de nouveaux peptides. La protéine contenant des ponts S-S est hydrolysée. L'hydrolysat est soumis à une première électrophorèse (Dimension 1). Le papier ayant servi de support d'électrophorèse en première dimension est traité avec la vapeur de l'acide performique qui oxyde tous les ponts S-S. Il est ensuite découpé et soumis à une autre électrophorèse dans les mêmes conditions (dimension 2). Les peptides qui contiennent des ponts S-S se répliquent en plusieurs autres ponts S-S.
Share this information on social mediaالإجتماعية
تبادل المعلومة عبر المواقع الإجتماعية الإجتماعية
 |
 |
 |
 |
 |
Protéines Q6 (Question
6).
La chromatographie de partage exploite le critère de la polarité
dans la séparation des molécules. La chromatographie
sur papier est un exemple.
1/ (Vrai). La Val possède une chaîne carbonnée non polaire. La Ser est un acide aminé polaire hydroxylé (hydroxyle sur C béta).
2/(Vrai). Gln (pHi = 5,65) et Asn (pHi = 5,41) ne sont
pas chargés à pH 6,0 (car pHi proche de 6). Ce sont des
acides aminés polaires. Néanmoins, la Gln possède un squelette carbonné plus long que celui de Asn et sera entraîné un peu plus loin.
3/(Vrai). Phe est un acide aminé aromatique (acide aminé cyclique) à caractère hydrophobe marqué.
Val est un acide aminé non polaire mais moins hydrophobe que Phe. Hydrophobicité croissante: Ala-Met-Cys-Phe-Leu-Val-Ile
4/(Faux). Lys (pHi = 9,59) sera chargée positivement à pH 6,0. Elle sera retenue par la phase stationnaire. Quant à Ileu (acide aminé non polaire, très hydrophobe), elle sera entraîné par la phase mobile.
5/(Faux). Asp (pHi = 2,77) est un acide aminé chargé
négativement à pH 6,0. Ala est un acide aminé
non polaire. Asp sera retenu par la phase stationnaire (polaire) alors
que Ala sera entraîné par la phase organique.
Protéines
Q7(Question 7)
Pour préciser la charge électrique d'un peptide à un pH déterminé, il faut connaître son PI.
- a: P (C), Q (C), R (C);
- b: P (C), Q (C), R (C);
- c: P (C), Q (O), R (A);
- d: P (A), Q (A), R (A).
-
Par exemple, à pH 2,0, le peptide Q porte une charge nette
de +1,5 (chaîne latérale Lys: +1; groupement alpha-aminé:
+1, chaîne latérale Glu: 0 et groupement carboxyle terminal:
-0,5, puisque le pH coïncide avec sa valeur de pK).
- A pH 4,0, la charge nette est +0,5; la chaîne latérale de Glu est à demi-ionisée (-0,5), mais le carboxyle terminal est presque complètement ionisé (-1).
Protéines Q8 (Question 8). Selon le principe de la séparation des protéines par électrophorèse, les critères moléculaires exploités par cette technique résident dans la charge électrique (liée au point isoélectrique (PI) ou pH isoionique (pHi))
et la taille ou
poids des molécules (masse molaire). De façon
plus simplifiée, la mobilité électrophorétique
d'une molécule soumise à l'électrophorèse
à pH déterminé (pH) peut-être exprimée
par la relation :
Mobilité = k . (pH - pI) / masse molaire, où pI est le point isoélectrique de la molécule.
En considérant le pH basique (pH = 8-9) de l'électrophorèse
et le fait que l'albumine du sérum présente le PI (PI = 4,7) et le poids moléculaire (PM
= 67 kDa) les plus petits par rapport aux globulines, elle migre rapidement
vers l'anode (+), car chargée très négativement
à pH basique (voir effet
du pH sur l'acquisition des charges électriques des acides aminés
et des protéines).
Les globulines ayant des PI (alpha: PI = 5,1, béta: PI = 5,6 et gamma: PI = 6,0) supérieurs par rapport à celui de l'albumine (PI = 4,7) et présentant globalement des poids moléculaires élevés, migrent moins vite vers l'anode.
Attention, concernant l'albumine, les recherches scientifiques ont montré que la forme (form, shape, شكل) peut intervenir dans la séparation par électrophorèse. Ainsi la
SAB peut présenter des changements de conformation spatiale (isomérisation)
en fonction du pH, qui peuvent être attribués à
des ruptures d'interactions de type ionique suite au changement
de pH. En particulier, un pH de 4,3 marque une transition entre
la forme native (N) de la protéine et la forme « fast »
(F) pour laquelle une diminution des structures en hélice est
observée (Carter, Carter, D.C. and Ho, J.X., Structure of serum
albumin. Adv Protein Chem, 1994. vol.45: p. 153-203). Avec la diminution
du pH, la structure est de plus en plus étirée.

Pour d'autres molécules comme les acides nucléiques (chargés négativement par le phosphate) et plus particulièrement pour les plasmides, la séparation par électrophorèse peut être influencée par la forme des molécules.
Toutes
les varaiations qualitatives et quantitatives montrées par l'électrophorégramme
des protéines sériques reflètent l'état
de santé des individus correspondants. Ainsi, l'Albumine et les
globulines alpha 1, alpha2 et béta, toutes synthétisées
au niveau du foie renseignent sur
la santé de cet organe. Les globulines gamma (immunoglobulines),
élaborées par les lymphocytes B activées reflètent
l'état du système immunitaire
humoral.
L'état de santé et la prise de médicaments peuvent changer la mobilité de l'albumine. Ainsi l'aspirine et la pénicilline entraient une augmentation de la mobilité de l'albumine.
Les diverses immunoglobulines (gammaglobulines) peuvent migrer de la zone
alpha1 à la zone gamma, mais se retrouvant principalement dans cette dernière zone, particulièrement
les immunoglobulines de type G (IgG). les IgA (PM = 180 kDa) et les
IgM de PM égal à 970 kDa (plus rarement les IgG de PM
150 kDa) peuvent migrer dans les fractions alpha2, béta1 et béta2
plutôt que dans la zone gamma. La forme arrondie de la zone gamma
du profil densitométrique résulte de la contribution de
millions de formes clonales d'immunoglobulines ayant une séquence
et des propriétés leur conférant une mobilité
électrophorétique différente, chacune provenant
d'un groupe restreint de plasmocytes. La prolifération anormale
d'un seul de ces clones dans le cadre d'une gammapathie
monoclonale se traduit par un excès relatif de l'immunoglobuline
spécifique que le clone produit. Ceci génère un
pic distinct à l'électrophorèse. Attention,
une gammapathie monoclonale de signification indéterminée
présente un risque d'évolution vers un myélome.
- Techniques en Biochimie. Préambule
- (gel exclusion chromatography, كروماتوغرافيا الإقصاء، كروماتوغرافيا التغلغل
- Chromatographie d'échange d'ions (ion exchange chromatography, كروماتوغرافيا التبادل الإيوني)
- Chromatographie d'affinité (Affinity chromatography, كروماتوغرافيا الألفة)
- Chromatographie d'interactions hydrophobes (hydrophobic interaction chromatography, كروماتوغرافياالتفاعل الهيدروفوبي)
- Chromatographie sur couche mince (CCM)
- DNA electrophoresis on agarose
gel - Chromatographie,
Electrophorèse. QCM
- Techniques en Biochimie. Préambule
- Polarité
- Forme
- Taille
- Ionicite
- Chromatographies

Comment avoir ces livres ? - أين يمكن اقتناء الكتب؟
Chaine
Youtube (abonnement). Vidéos multilingues

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.