La chromatographie interaction hydrophobe (hydrophobic interaction chromatography, كروماتوغرافياالتفاعل الهيدروفوبي) exploite l'expression de l'hydrophobie des protéines en présence d'une force ionique élevée (concentration élevée en sels)
كروماتوغرافيا التفاعل الهيدروفوبي تستغل التعبير عن هيدروفوبية البروتين في وجود قوة أيونية عالية (تركيز عالي للملح)
La chromatographie d'interaction hydrophobe (hydrophobic interaction chromatography, كروماتوغرافياالتفاعل الهيدروفوبي) sépare les protéines en fonction de leur caractère hydrophobe. Son principe repose sur le fait qu'en présence d'une force ionique élevée (fortes concentrations en sels), les molécules d'eau constituant l'enveloppe d'hydratation des protéines sont déplacées pour hydrater les anions et les cations provenant de la dissociation du sel (relargage, salting out). Ceci entraine une réorganisation des molécules d'eau autour des protéines et l'exposition de leurs zones hydrophobes favorisant l'établissement d'interactions hydrophobes entre ces zones (normalement enfouies) et les groupements hydrophobes portés par la phase stationnaire. Les protéines qui se lient à la phase stationnaire réadoptent leur conformation native lorsqu'un tampon avec une force ionique faible est ajouté. Il en résulte une élution des protéines.
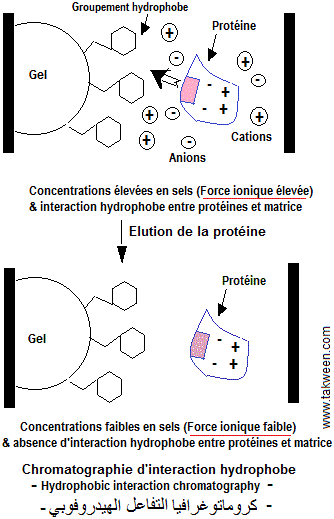
Le gel de chromatographie d'interaction hydrophobe porte un groupement hydrophobe comme un noyau phénol à l'extrémité d'une chaîne carbonée. Ce groupe hydrophobe interagit avec les zones hydrophobes situées à la surface des protéines. La chromatographie d'interaction hydrophobe peut être une méthode de séparation précieuse pour la purification des protéines qui peuvent se replier spontanément par une diminution de la force ionique. Cependant, sous crainte de précipitation par les sels d'une protéine d'intérêt, la force ionique du tampon de liaison doit être aussi faible que possible pour lier la protéine, tout en empêchant sa précipitation. Pour éviter le risque de précipitation, une force ionique plus faible peut être utilisée. Dans le cas contraire, il faut faire fixer les protéines contaminantes et récupérer la protéine d'intérêt dans la fraction non retenue.
Procédures:
Avant de charger l'échantillon sur la colonne, la phase stationnaire
doit être équilibrée avec le tampon de force ionique élevée (le même tampon dans lequel l'échantillon de protéine sera chargé sur la colonne). L'échantillon
est ensuite déposé sur la colonne qui est est lavée
intensivement. La protéine d'intérêt est éluée
avec un tampon de force ionique faible. Ainsi, les ions du sel étant
progressivement éliminés, les acides aminés chargés (ou polaires) à la surface de la protéine d'intérêt rétablissent à nouveau des liaisons hydrogène
avec la phase mobile, d'où une augmentation de la solubilité de la protéine provoquant son élution.
Types de groupe fonctionnel hydrophobe:
La phase stationnaire utilisée pour la chromatographie d'interaction hydrophobe est composée d'une matrice de base faite d'agarose
réticulé ou d'un copolymère synthétique.
Un ligand alkyle ou aryle est ensuite conjugué à la
matrice de base, fournissant une spécificité pour des molécules hydrophobes.
- Alkyle: une chaîne hydrocarbonée de différentes longueurs; souvent un groupe butyle ou octyle est utilisé. La capacité de liaison de la phase stationnaire est augmentée
avec l'augmentation de longueur de chaîne alkyle Les groupes
fonctionnels lient des protéines entièrement sur l'hydrophobicité
de la protéine
- Aryle: un groupe fonctionnel dérivé d'un cycle
aromatique; souvent un groupe phényle. Les groupes aryle offrent
spécificité croissante, les protéines peuvent
également interagir avec le groupe fonctionnel grâce
à des interactions d'empilement de base.
A
quelles étapes utilise-t-on la chromatographie d'interaction hydrophobe?
La chromatographie d'interaction hydrophobe est souvent utilisée
comme une étape intermédiaire dans un protocole de purification.
Les protéines sont liées à une phase stationnaire
dans un tampon de force ionique élevée. De ce fait,
elle peut typiquement être réalisée immédiatement
après la chromatographie
par échange d'ions, sans échange de tampon ou de
dilution nécessaire. De même, la chromatographie d'interaction
hydrophobe est couramment réalisée après une
précipitation au sulfate
d'ammonium. Parfois la chromatographie d'interaction hydrophobe
est applicable dans les premières étapes d'un protocole
de purification ou en tant qu'étape finale visant l'élimination
des traces d'impuretés de la protéine d'intérêt.
| Problème | Cause | Solution |
| La protéine ne se lie pas à la colonne | La colonne n'a pas été équilibrée | Faire passer plus de tampon d'équilibration sur la colonne et recharger la protéine |
| La force ionique du tampon de liaison est trop faible | Augmenter la force ionique du tampon | |
| La protéine s'agrège à la force ionique utilisée | Diminuer la force ionique du tampon ou essayer un sel diffèrent | |
| La protéine n'est pas éluée | La force ionique du tampon d'élution est trop élevée | Diminuer la force ionique |
| La protéine est agrégée sur la colonne | Ajuster les conditions du tampon pour une meilleure stabilité de la protéine | |
| La rétention est trop élevée | Essayer une phase stationnaire différente qui offre moins de rétention | |
| Résolution faible | Le débit est soit trop élevé ou trop faible | Ajuster le débit |
| La colonne n'a pas été lavée suffisamment | Laver avec un tampon de force ionique plus faible, nettoyer la phase stationnaire en suivant les recommandations du fournisseur | |
| La protéine est agrégée sur la colonne | Ajuster les conditions du tampon pour une meilleure stabilité des protéines | |
| faible rétention sur la colonne | Essayer une phase stationnaire différente qui offre une meilleure rétention | |
| La protéine perd son activité pendant la procédure | La protéine est dénaturée ou agrégée | Ajuster les conditions du tampon pour une meilleure stabilité des protéines |
| La protéine n'est pas revenue à sa conformation native | Essayer la liaison avec un sel différent ou à une force ionique plus faible, ajouter des additifs permettant une meilleure stabilité de la protéine | |
| Un cofacteur nécessaire à l'activité a été éliminé pendant la purification | Ajouter le cofacteur |
Plus de détails: https://www.labome.fr/method/Protein-Purification.html
Share this information on social mediaالإجتماعية
تبادل المعلومة عبر المواقع الإجتماعية الإجتماعية
 |
 |
 |
 |
- Examen contrôle corrigé du module techniques analyses, FSSM, 2023
- Examen contrôle corrigé du module techniques analyses, FSSM, 2021
- Examen contrôle corrigé du TP du module techniques analyses, FSSM, 2021
- Chromatographie sur papier
- Chromatographie
sur couche mince (CCM)
- Séparation
des protéines (chromatographie, ..). Exercices
- chromatographie d'exclusion ou perméation (gel exclusion chromatography, كروماتوغرافيا
الإقصاء، كروماتوغرافيا التغلغل
- Chromatographie
d'échange d'ions (ion exchange chromatography, كروماتوغرافيا
التبادل الإيوني)
- Chromatographie d'affinité (Affinity chromatography, كروماتوغرافيا
الألفة)
- Chromatographie,
Electrophorèse. QCM
Techniques basées sur le(s) critère(s):
- Polarité
- Taille
- Forme
-
Ionicité

360 pages, 2018, ISBN : 978-9920-35-345-8 + DVD mis à jour + Assistance.

Comment avoir ces livres ? - أين يمكن اقتناء الكتب؟
Chaine
Youtube (abonnement). Vidéos multilingues

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.