| French
|
Arabic
|
English
|
| Ionisation des acide aminés |
تأين الأحماض الأمينية |
Aminoacid ionisation |
| Saturation des groupes ionisables par H+ en ajoutant un acide |
تشبع بالبروتونات H+ للمجموعات المتأينة بإضافة حمض |
Saturation of ionizing groups with H+ by adding an acid |
| Dissociation (perte de H+) des groupes ionisables par addition d'une base |
تفكك المجموعات المتأينة (فقدان H+) بإضافة قاعدة |
Dissociation (loss of H+) of ionizing groups by adding a base |
La
dissociation et l'ionisation des acides aminés (تفكك وتأين الأحماض الأمينية) donnent lieu à plusieurs espèces chimiques du même acide aminé. Tout dépend du pH dans lequel se trouve l'acide aminé. Les pK de dissociation de chaque fonction ionisable sont à prendre en considération dans tout calcul. Le pourcentage des espèces chimiques d'un acide aminé est relié au pH et au pK de la fonction ionisable via l'équation de Henderson-Hasselbalch:
pH = pK + log ([base]/[acide]), exemple: pH = pK + log ([A-]/[AH]), avec AH forme acide et A- sa base conjugeée.
Pour calculer la charge électrique globale d'une fonction ionisable précise pour un acide aminé déterminé mis à pH précis, il faut comparer ce dernier au pK de la fonction ionisable. Généralement 3 situations se présentent:
1) Situation de pH extrême: si le pH est à plus de 2 unités par rapport au pK de la fonction ionisable (avant ou après), on sera à 100% de la forme saturée ou dissociée.
2) Situation de pH proche de pK: si le pH est à moins de 2 unités par rapport au pK de la fonction ionisable (avant ou après), on calcule avec l'équation de Henderson-Hasselbalch le pourcentage des formes chargées - ou + (les formes non chargées n'interviennent plus) et sachant que [base] + [acide] = 1.
3) Situation de pH = pK: 50% de la forme saturée et 50% de la forme dissociée (charge -0,5 ou + 0,5).
EXERCICE 1. La déprotonation (dissociation) de l'Arginine en solution, se fait selon les équilibres de constantes k1, k2 et k3 en commençant par le pK le plus petit (le plus acide)
a) avec les pK1, pK2 et pKR montrées dans la figure suivante, déterminer le pHi de l'Arginine
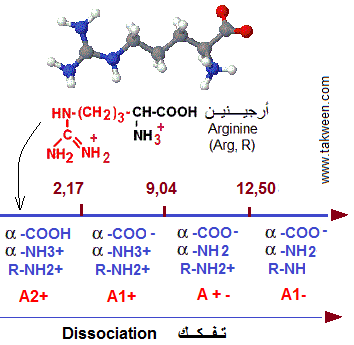
b) Calculer les pourcentages des espèces chimiques (formes ioniques) aux pH 3,0, 10,75 et 12,50 dans une solution d'Arginine 1M.
---> Voir détail de la réponse

QUESTION
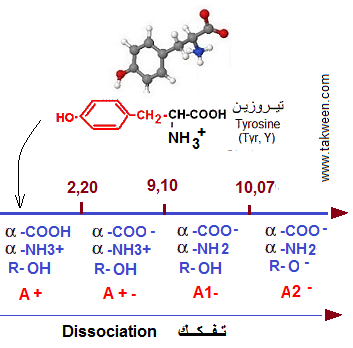
3. La tyrosine en solution aqueuse présente les pK montrés
dans la figure ci dessous. Calculer le ou les pH possibles pour une solution
de tyrosine de concentration 1 M, sachant que 40% de cet acide aminé
est sous forme non chargée.
Réponse à Q1--Question 1
a): Le pHi est la moyenne des pK qui entourent l'espèce
chimique (forme) A+-: pHi = (pK2 + pKR)/2 = (9,04 + 12,48)/2 = 10,76.
b): Le pourcentages des espèces chimiques dépend
du pH de la solution. On utilise la relation de Henderson- Hasselbalch;
pH = pK + log ([base]/[acide])
A pH 3,0 (proche de pK1):
- Espèces chimiques alpha carboxylés à pH 3,0:
pH = pK1 + log([base]/[acide]) = pK + log([COO-]/[COOH]), ceci donne
log([COO-]/[COOH]) = pH- pK1, donc [COO-]/[COOH] = 10 puissance (pH-pK1)
= 10 puissance (3 - 2,17) = 6,76
On a donc: [COO-]/[COOH] = 6,76 et
[COO-] + [COOH] = 1 M
d'où : 6,76 x [COOH] + [COO-] = 1 ou 7,76 [COOH] = 1 et [COOH]
= 1/7,76 = 0,129 M ou 12,9% avec 1M = 100%
On en déduit [COO-] = 0,871 M, soit [COO-] = 87,1%
Conclusion: A ce pH, 87,1% de la fonction alpha carboxyle est dissociée
- Espèces chimiques alpha aminés à pH 3,0:
pH = pK2 + log([base]/[acide]) = pK + log([NH2]/[NH3+]), ceci donne
log([NH2]/[NH3+]) = pH- pK2, donc [NH2]/[NH3+] = 10 puissance (pH-pK2)
= 10 puissance (3 - 9,04) = 9,12 x 10 puissance -7
On a donc: [NH2]/[NH3+] = 9,12 x 10 puissance -7 et
[NH2] + [NH3+] = 1 M
d'où : [NH2] négligeable (la fonction alpha aminé n'est pas encore dissociéé à ce pH)
On en déduit [NH3+] = 1 - 0 M, soit [HN3+] = 1 M = 100%
- Espèces chimiques du radical R à pH 3,0:
pH = pKR + log([base]/[acide]) = pK + log([RNH]/[RNH2+]), ceci donne log([RNH]/[RNH2+]) = pH- pKR, donc [RNH]/[RNH2+] = 10 puissance (pH-pKR)
= 10 puissance (3 - 12,48)
On a donc: [RNH]/[RNH2+] = 10 puissance 3-12,48 = 3,33 x 10 puissance(-10)
et
[RNH] + [RNH2+] = 1 M
d'où : [RNH] négligeable
On en déduit [RN23+] = 1 - 0 M, soit [RHN2+] = 1 M = 100%
A pH 10,75 (entre pK2 et de pKR):
Espèces chimiques alpha carboxylés à pH 10,75:
On suit la même méthode qu'avec le pH 3,0.
Espèces chimiques alpha carboxylés à pH 10,75:
[COOH] = 0% [COO-] = 100%
Espèces chimiques alpha aminés à pH 10,75:
[NH2] = 0,981 M soit 98,1% [NH3+] = 1,91%
Espèces chimiques du radical R à pH 10,75:
[RNH] = 0,0182 M soit 1,82% [RNH2+] = 98,18%
A pH 12,48 (environ pKR):
Espèces chimiques alpha carboxylés à pH 12;48:
On suit la même méthode qu'avec le pH 3,0.
Espèces chimiques alpha carboxylés à pH 12,48:
[COOH] = 0% [COO-] = 100%
Espèces chimiques alpha aminés à pH 12,48:
[NH2] = 0,999 M soit 99,9% [NH3+] = 0,036%
Espèces chimiques du radical R à pH 12,48:
[RNH] = 0,5 M soit 50% [RNH2+] = 50%
Réponse à Q 2 --Question 2
Rappel: les pK correspondent au pH de demi-dissociation. Ici le pKR coïncide avec 50% de la forme A+- et 50% de la forme A-.
A pH 5,0, pH loins du pK1 (forme alpha COOH), le pK recherché est le pKR. La relation de Henderson- Hasselbalch; pH = pK + log ([base]/[acide]) s'appliquant ici est pH = pKR + log ([RCOO-]/[RCOOH]) avec [RCOO-] + [RCOOH]=
100% (ou 1).
A pH 5,0, (proche de pKR) la forme neutre A+- porte RCOOH (voir schéma), donc [RCOOH] = 6,75%. Il en resulte [RCOO-] = 93,25%
Recherche de pKR: pKR = 5 - log (93,25/6,75) = 3,86 = pKR
 |
 |
 |
Réponse à Q3 ---Question 3
Le pHi de la tyrosine sera la myenne des pK entrouant la forme A+-. Ici, pHi = (pK1 + pK2)/2 = (2,2 = 9,1)/2 = 5,65.
Pour que 40% de la tyrosine soit non chargée, deux possibilités se présentent correspondant à deux pH:
1) 40% d'acide aminé neutre (A+-) et 60% chargé + (proche de pK1) ---> pH1. Pour appliquer la règle d'Henderson-Hasselbalch: pH = pK + log [(base)/(acide)] dans cette situation, la forme (acide) sera (A+) et la forme (base) sera (A+-) (voir schema)
2) 40% d'acide aminé neutre et 60% chargé - (proche de pK2) ---> pH2. Pour appliquer la règle d'Henderson-Hasselbalch dans cette situation, la forme (acide) sera (A+-) et la forme (base) sera (A-) (voir schema)
Calcul du pH1 (couple des formes A+/A+-): pH = pK1 + log ([A+]/[A+-]) = 2,2 + log (40/60) = 2,02 = pH1
Calcul du pH2 (couple des formes A+-/A-): pH = pK2 + log ([A+-]/[A-]) = 9,1 + log (60/40) = 9,29 = pH2
Réponse à Q4 --- Question 4
Pour l'acide aspartique, adoptons pK(alpha-COOH) = 2, pK(alpha-NH2) = 9 et pK(R-COOH) = 3,9.
A pH 2, on est dans un pH égal au pK(alpha-COOH) de la fonction alpha-COOH, dans un pH extrême pour la fonction alpha-NH2 (pH inférieur ou supérieur d'au moins 2 unités de pH par rapport au pK(alpha-NH2)) et dans un pH proche de pK(R-COOH). La fonction acide pK(alpha-COOH) = pH, est à moitié dissociée (50% COOH, 50% COO-) et apporte une charge de -0,5. La fonction basique, reste totalement saturée à pH acide, apporte une charge de +1 (alpha-NH3+). Il faut ensuite calculer le pourcentage d'acide/base de la fonction acide de la chaine latérale (R-COOH) (il reste encore des charges - provenant du radical (forme A-)) avec la relation d'Henderson-Hasselbach
qui est ici:
pH = pKR + (log (base A-/acide AH).
pH=pKR + log(A-/AH) => log(A-/AH) = 2-3,9
=> (A-/AH)=10^(-1,9) = 0,0126
Or (A-)+(AH) = 100% =1 => (A-) =1- (AH)
=> 1- (AH) = 0,0126(AH), soit 1 = 0,0126(AH) + (AH) ou 1 = (AH)(1+0,0126)
=> (AH) = 1/1,0126 = 98,8% ou 0,988
Comme (AH) + (A-) = 1, (A-) sera égale à 1 - 0,988 = 0,12 ou 1,2% et il apporte une charge de -0,012
Charge globale : +1-0,5-0,012 = +0,488. De ce fait, à pH 2, la fonction amine contribue avec une charge égale à +1, la fonction acide (alpha COOH) donne -0,5 et la fonction COOH du radical donne -0,012
- Biochimie structurale (Contrôle final QCM corrigé, S3 (archives 2024)
- Acides aminés, structure et propriétés. QCM
- Acides aminés dicarboxyliques (أحماض أمينية ثنائية الكاربوكسيل)
- Acides aminés
soufrés (أحماض أمينية مكبرتة)
- Acides aminés
à chaîne hydrocarbonnée (أحماض أمينية
بسلسلة هيدروكربونية)
- Acides aminés
hydroxylés (أحماض أمينية هيدروكسيلية)
- Acides aminés
basiques (أحماض أمينية قاعدية)
- Acides aminés
cycliques (أحماض أمينية حلقية)
- Acides aminés à
amides
- Acides aminés. Exercices
- Acides aminés.
Ionisation (Exercices)
- Acides aminés.
Structure et propriétés (QCM)
- Protéines, peptides
(contrôles)
- Ionisation des
acides aminés, texte Ar
- أحماض أمينية. تأين ومعايرة Amino-acids. Ionization, titration
- Peptides,
protéines. Exercices
- QCM métabolisme des acides aminés

Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.

Takween.
Supports
-Glossaire trilingues
Français-Arabe-Anglais



Chaine Youtube
(abonnement). Plusieurs vidéos multilingues
 Enseignements par semestres
Enseignements par semestres
Congrès,
Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo
annonces