Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي

Dans le cas de plusieurs substrats, le suivi de la cinetique enzymatiques permet d'élucider les mécanismes de catalyse des réactions enzymatiques à 2 substrats (ميكانزمات التفاعلات الإنزيمية بمادتين أساسيتين) catalysées par des enzymesprécises. Les paramètres cinétiques correspondants sont calculés. L'effet des activateurs et des inhibiteurs reversibles sur le déroulement de l'activité enzymatique est tributaire des complexes que l'enzyme forme avec ces modulateurs.
- Moyens de détermination des mécanismes de catalyse des réactions enzymatiques à plusieurs substrats
--- Utilisation des analogues de substrats
--- Utilisation des modes d'inhibition par les produits de la réaction (Règles de Cleland, 1963)
--- Utilisation d'autres méthodes
MECANISMES
DE CATALYSE ENZYMATIQUE A DEUX SUBSTRATS
Examens
1.6.1. Généralités
La plupart des réactions enzymatiques impliquent 2 substrats. Le
deuxième substrat peut être de l'eau pour les réactions
d'hydrolyse ou un donneur ou un accepteur d'électrons pour les
réactions d'oxydoréduction (coenzyme dissociable). La
réaction à 2 substrats (S1, S2) et 2 produits (P1, P2)
s'exprime par la relation:
S1 + S2 <--------> P1 + P2
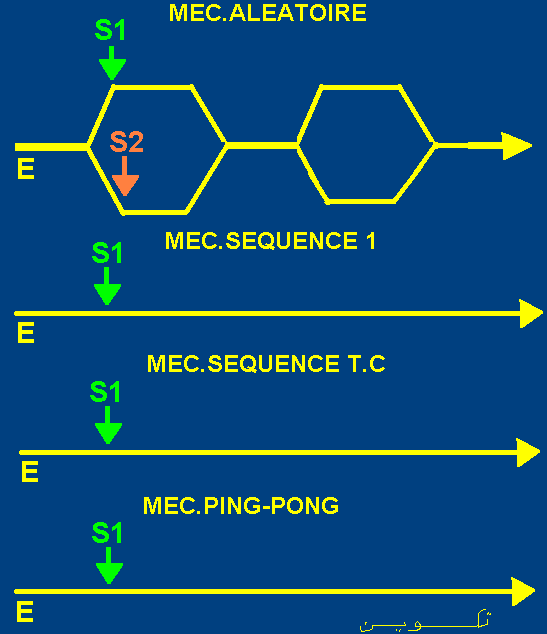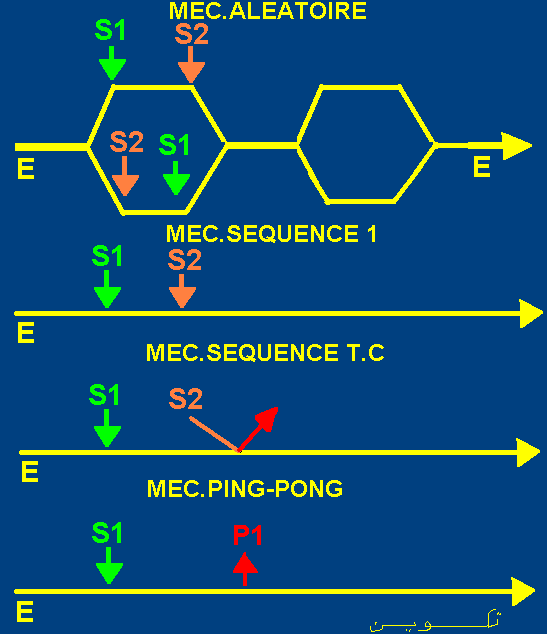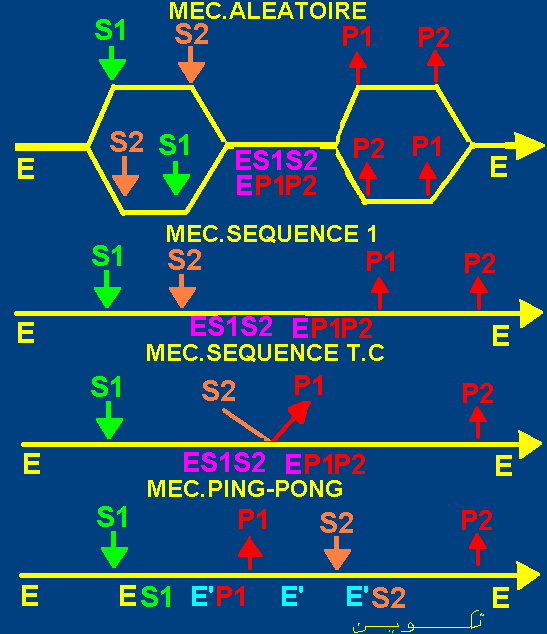
Le mécanisme réactionnel
fait intervenir plusieurs combinaisons enzyme-substrats qui peuvent
être des combinaisons binaires
(ES1, ES2, EP1, EP2) ou ternaires
(ES1S2, ES1P2, ES2P1, EP1P2,...).
Le nombre de substrats ou de produits est indiqué par des préfixes
Uni, Bi, Ter,...
Si 1s et 2P, la réaction est dite Uni-Bi. Si 2S et 2P, la réaction
est dite Bi-Bi.
Deux grands types de mécanismes réactionnels sont décrits:
1. Mécanismes où l'ordre de fixation des S et des P
est obligatoires (M.séquencés)
2. Mécanismes où l'ordre de fixation des S et des P
n'est pas obligatoires (M.au hasard ou M.aléatoires)
Certains mécanismes sont connus par l'absence de formation de complexes
ternaires et la présence d'une 'enzyme transitoire'. Ce sont
des mécanismes 'Ping-Pong'
Les principaux mécanismes de catalyse enzymatiques à2 substrats sont:
Mécanismes de catalyse aléatoires.
- Mécanisme au hasard, fixation dépendante. - Mécanisme au hasard, fixation indépendante.
- Mécanismes ordonnés. dont le Mécanisme séquencé et le
Mécanisme Theorell-Chance (Mec.Séquencé T.C).
Mécanisme Ping-Pong.
ميكانزمات التفاعلات الإنزيمية بمادتين أساسيتين
أغلبية التفاعلات الإنزيمية تستخدم مادتين أساسيتين في التحفيز. قد تكون المادة الأساسية (التفاعلية) عبارة عن الماء في تفاعلات الحلمأة أو مزود أو مستقبل للبروتونات في تفاعلات الأكسدة والاختزال. بحضور إنزيم ما (E)، يعبر عن التفاعلات الإنزيمية بمادتين أساسيتين (S1 وS2) وناتجين إثنين (P1 وP2) بالتوازن:
S1 + S2 <-----> P1 + P2
تتضمن
الميكانزمات التفاعلية عدة معقدات من أنواع إنزيم-مواد الأساس و إنزيم-نواتج قد تكون ثنائية (Complexes binaires)، ES1 و ES2 و EP1 و EP2 أو معقدات ثلاثية مثل (Complexes ternaires) مثل ES1S2 و ES1P2 و ES2P1 و EP1P2. يمكن التطرق لثلاثة ميكانزمات كبرى:
ميكانزمات عشوائية (Mécanismes aléatoire, au hasard) لا تتطلب أي ترتيب في ارتباط الإنزيم بمادتي التفاعل و إفراز النواتج
مع تكون معقدات ثنائية و ثلاثية بين الإنزيم
و مواد التفاعل و بين الإنزيم والنواتج.
وحده المعقد ES1S2 يعتبر معقدا منتجا
(Complexe productif). لا يمكن أبدا التكلم عن مادة
الأساس الأولى أو الثانية في الارتباط
مع الإنزيم و نفس الشئ بالنسبة للنواتج.
ميكانزمات مرتبة
(Mécanismes ordonnés, séquencés) تتميز
بنظام يطبعه الترتيب في ارتباط الإنزيم
بمادتي التفاعل و ظهور النواتج مع تكون
معقدات ثنائية و ثلاثية بين الإنزيم و
مواد التفاعل و بين الإنزيم والنواتج.
في هذه الحالة، لا بد أن ترتبط مادة التفاعل
الأولى بالإنزيم حتى تمكن من ارتباط مادة
الأساس الثانية و تشكيل معقد ثلاثي منتج.
لهذا يصبح التنظيم ضروريا لقيام التحفيز
الإنزيمي.
ميكانزمات تتميز
بظهور معقدات ثنائية فقط بين الإنزيم و مواد التفاعل وبين الإنزيم و النواتج
وتسمى 'ميكانزمات بينغ-بونغ' (Mécanismes
ping-pong) مع ظهور إنزيم ظرفي (Enzyme transitoire).
في هذه الحالة، تعتبر المعقدات الثنائية
معقدات منتجة.
Les mécanismes de catalyses sont schématisés par la 'Représentation de Cleland' dont l'exemple suivant (mécanisme séquencé) illustre cette représentation.

La figure suivante résume les principaux types de mécanismes de catalyse des réactions enzymatiques à 2 substrats.
Moyens de détermination des mécanismes de catalyse des réactions enzymatiques à plusieurs substrats.
L'étude des réactions enzymatiques à
2 S consiste à determiner l'ordre de fixation des substrats,
les constantes d'affinité de chacun d'eux en présence
ou en absence de l'autre et la vitesse maximale de la réaction,
lorsque les 2 substrats sont en concentrations saturantes.
1.6.2.1. Utilisation des analogues de substrats.
Une des approches permettant de déterminer l'ordre de fixation des substrats consiste à étudier le type d'inhibition par les analogues de substrats. Ces substances se comportent souvent comme inhibiteurs compétitifs des substrats dont ils sont analogues. Mais ils peuvent se comporter vis à vis de l'autre substrat comme
des inhibiteurs de types différents.
Considérons le cas général où on peut imaginer toutes les
possibilités de fixation.

Utilisation
d'un analogue structural de S2 (S2'). S2' peut se comporter vis à
vis de S1 comme:
1/ Inhibiteur incompétitif/S1: si S2' ne peut se lier
à l'enzyme qu'une fois S1 est fixé sur l'enzyme (S1
est un 'substrat directeur'). Ce type d'inhibition indique la présence
d'un mécanisme séquencé (voir les types
d'inhibiteurs).
2/ Inhibiteur non compétitif ou mixte/S1: si S2' (inhibiteur)
peut se fixer sur l'enzyme en absence de S1. Ce type d'inhibition
indique la présence d'un mécanisme au hasard (voir les
types d'inhibiteurs)..
1.6.2.2.
Utilisation des modes d'inhibition par les produits de la réaction
(Règles de Cleland, 1963)..
L'apparition des produits d'une réaction enzymatique à 2 substrats
peut avoir un effet inhibiteur qui diffère selon le mécanisme
de catalyse. Ces modes d'inhibition sont définis suivant les
règles de Cleland (1963):
Rappelons que le mode d'inhibition peut être défini à l'aide
des graphiques 1/v = f(1/(S)) en connaissant l'état des pentes
des droites et l'état des intersections des droites avec l'axe
des ordonnées.
Règle 1: Changement des intersections
1/v = f(1/(S)) avec l'axe des ordonnées: Un effecteur (produit
d'une réaction) affectera uniquement l'intersection des droites 1/v
= f(1/(S)) s'il se fixe réversiblement sur une forme enzymatique autre
que celle sur laquelle s'est fixé le substrat. Cet effecteur sera un
inhibiteur incompétitif .
Règle 2: Changement des pentes des droites 1/v = f(1/(S)):Un
effecteur affectera uniquement les pentes des droites 1/v = f(1/(S))
s'il se fixe soit sur la même forme enzymatique que celle ayant
fixé le substrat, soit sur une autre forme enzymatique que
celle se combinant au substrat, mais séparée de celle
ci par une ou plusieurs étapes réversibles. Cette effecteur
sera un inhibiteur
compétitif.
Un effecteur qui affectera à la fois les intersections des
droites 1/v = f(1/(S)) avec l'axe des ordonnées et les pentes
sera un inhibiteur non compétitif
ou mixte.
Cas d'irreversibilité.
Une série d'étapes réactionnelles réversibles
séparant la fixation d'un substrat (S) et d'un produit (P)
sera considérée comme irréversible lorsque:
1/ Les deux étapes de fixation de S et de P seront séparées
par une étape d'addition d'un autre substrat dont la concentration
est saturante.
2/ Les deux étapes de fixation de S et de P seront séparées
par une étape de libération d'un produit dont la concentration
sera considérée comme nulle (cas des mesures en vitesses
initiales).
Exemple:
Soit le mécanisme séquencé suivant:
E <--+ S1--> ES1 <--+ S2--> ES1S2 <-->
EP1P2 <-+ P1--> EP2 <--+ P2-->E
Inhibition exercée par P1
1/ vis à vis de S1 ((S1) variable, (S2) constante): le type d'inhibition dépend de la concentration de S2
1.1/ (S2) non saturante: P1 se fixe sur EP2, forme différente
de E sur laquelle se fixe S1. L'intersection des droites 1/v = f(1/(S))
avec l'axe des ordonnées est affectée. Il existe entre
P1 et S1 une série d'étapes réversibles: pente
des droites 1/v = f(1/(S)) affectée. Donc, P1 est non compétitif
ou mixte vis à vis de S1.
1.2/ (S2) saturante: il existe une étape irreversible entre
S1 et P1 (ES1 est transformé en ES1S2). En plus, la fixation
se fait sur des formes différentes (E et EP2). La pente n'est
pas affectée. Seule l'intersection est affectée. P1
est incompétitif vis à vis de S1.
Utilisation d'autres
méthodes.
Exemple de la Dialyse à l'équilibre.
Un appareil de dialyse à l'équilibre est constitué de 2 compartiments (A et B) séparés
par une membrane semi-permeable. Le compartiment A contient l'enzyme
(E) (solution de concentration connue). Le compartiment B contient
un analogue de substrat (S) (remplaçant le substrat car le
complexe ES est souvent instable).

Seul le substrat peut diffuser à travers la membrane jusqu'à l'équilibre des activités chimique. L'équilibre est fait entre les molécules de S' libres de part et d'autre. Les molécules de S' fixées à l'enzyme n'interviennent pas dans l'équilibre. La formation d'un complexe entre l'enzyme et le substrat S' (ES') se traduit par un excès de S' dans le compartiment A. (ES') = (S')A - (S')B.
- Mécanisme de catalyse au
hasard fixation dépendante
- Mécanisme de catalyse au
hasard fixation indépendante
- Mécanisme de catalyse ping-pong
- Mécanisme de catalyse au ordonné
(séquencé)
- Enzymologie-enzymes (exercices)
- QCM-Enzymes. Structure et fonction
(bases)
- Hexokinase
- Coenzyme Atransférase
- Amine oxydase
- Inhibiteurs. Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Phospholipase, Allostérie
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase.
Examen S5
- Phospholipase A2.Examen
E-books
- VIDEO 'ENZYMES, CATALYSEURS
BIOLOGIQUES (Ar, Fr)'
Actions
takween pour la promotion de la culture scientifique et la réussite de la transition Lycée-Université
تكوين. دعم الثقافة العلمية و مواكبة الانتقال
من الثانوية إلى الجامعة
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.

Chaine Youtube (abonnement).
Plusieurs vidéos multilingues
- تحميل ملفات في مواضيع البيوكيمياء Téléchargement de fichiers en Biochimie

- آفاق الدراسات بكليات العلوم و رد الاعتبار لمؤسسات ا لتعليم العالي ذات الاستقطاب المفتوح
- Congrès,Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo. annonces