Takween. Sciences de la vie,
Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Takween. Sciences de la vie,
Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
En enzymologie, lesinhibiteurs compétitif et incompétitif sont caractérisés par la formation de complexes binaires et ternaires avec l'enzyme et le substrat, respectivement.
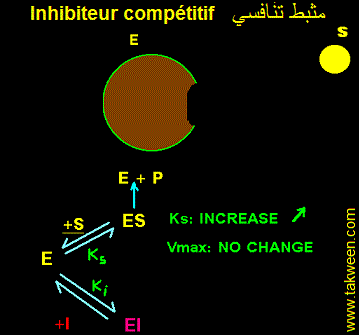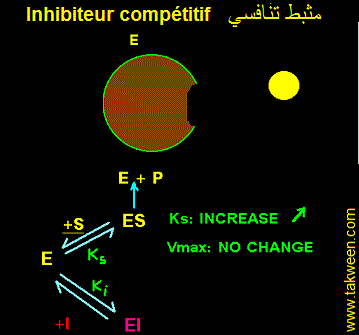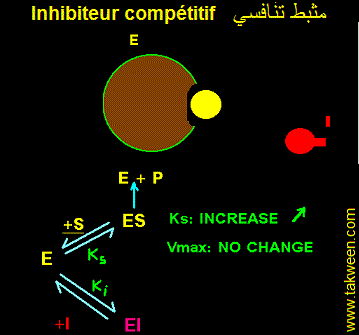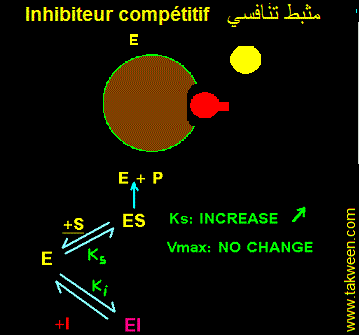
FIXATION DE L'INHIBITEUR SUR LA FORME LIBRE DE L'ENZYME (E). INHIBITEUR COMPETITIF
- Remarque sur l'inhibieur compétitif
- Equation de vitesse
- Représentation graphique
- Vidéo de l'inhibiteur compétitif:
-- Equation de vitesse
- Représentation graphique
- Vidéo de l'inhibiteur incompétitif
QUIZ INTRODUCTIF
Question L'inhibieur qui ne se fixe jamais sur l'enzyme libre, exigeant d'abord la fixation du substrat sur celle ci est:
(!Inhibieur compétitif)(Inhibiteur incompétitif)
 |
 |
 |
 |
 |
Inhibiteurs compétitif et incompétitif
Interactions moléculaire Enzyme - Substrat - Inhibiteur
Les
inhibiteurs des réactions enzymatiques appartiennent à
deux grandes classes:
1: Les inhibiteurs réversibles
qui se fixent sur l'enzyme à l'aide de liaisons faibles comme
celles engagées entre l'enzyme et le substrat. Celles ci se
forment rapidement et peuent être rompues facilement (E +
I <--> EI).
2: Les inhibiteurs irréversibles connus
sous le terme 'inactivateur d'enzymes' se combinent à l'enzyme
par formation de liaisons covalentes. l'enzyme est totalement inactivée
(E + I --> EI).
FIXATION DE L'INHIBITEUR SUR LA FORME LIBRE DE L'ENZYME (E). INHIBITEUR COMPETITIF
L'inhibiteur se fixe uniquement sur l'enzyme libre E + S <---> ES ---> E + P et E + I <---> EI. Seul le complexe ES est productif. La constante k3 caractérise ES ---> E + P. La vitesse v = k3.(ES). La fixation d'un inhibiteur (I) sur (E) aboutit à la formation d'un complexe binaire (EI) complètement déplaçable en présence d'un excès de substrat (l'une des conditions de mesure de la vitesse maximale (Vmax)). Autrement dit, il est possible de décrocher l'inhibiteur fixé sur l'enzyme et le remplacer par le substrat. Donc, la Vmax déterminée en présence de I ne changera pas par rapport à celle obtenue en absence de I.

Par contre la fixaion de I sur E déplace l'équilibre E <----> ES en faveur de E dont la concentration augmente au dépend de celle de ES. Donc Ks (Ks = [(E)(S)]/(ES)) augmente. Ks' (presence de I) sera multiplié par un facteur à déterminer. L'affinité de l'enzyme pour S diminue.
REMARQUE SUR L'INHIBITION COMPETITIVE
Remarque: L'inhibition compétitive peut résulter d'une compétition entre le substrat et l'inhibiteur pour occuper le même site. Il s'agit d'un inhibiteur isostérique. Aussi, une inhibition compétitive peut être obtenue par chagement conformationnel de l'enzyme suite à la fixation de l'inhibiteur sur un site différent du site actif. Il s'agit d'un inhibieur allostérique qui ne présente pas obligatoirement une analogie structurale avec le substrat. Aussi bien dans le premier cas que dans le deuxième cas, l'inhibiteur et le substrat sont exclusif l'un de l'autre.
EQUATION DE VITESSE DE L'INHIBITEUR COMPETITIF
En considérant les réactions montrées par la figure ci dessus, Ks = (E)(S)/(ES) et KI = (E)(I)/(EI), d'autre part: v = k3.(ES) et Vmax = k3.(ET)
avec (ET) = (E) + (ES) + (EI)
v/Vmax = (ES)/(ET) = (ES)/[(E) + (ES) + (EI)].
Sachant que (E) = Ks.(ES)/(S) et (EI) = (E)(I)/Ki, v/Vmax = (ES)/[(ES).Ks/(S)
+ (ES) + (ES).Ks/(S).(I)/Ki].
En simplifiant par (ES): v/Vmax = 1/[Ks/(S) + 1 + Ks.(I)/Ki] qui peut être
ecrite en multipliant par (S):
v/Vmax = (S)/[(S) + Ks.(1 + (I)/Ki)], d'où:

Donc, en présence de I, l'affinité de l'enzyme pour son substrat est diminuée, car Ks a augmenté (multiplication par le facteur (1 + (I)/Ki)
En coordonnées inverses 1/v = f(1/(S), l'équation devient:
1/v = [1 + (I)/Ki]Ks/Vmax. 1/(S) + 1/Vmax qui est de la forme y = ax + b (équation de la représentation de Lineweaver-Burk) (plus de détails).
REPRESENTATION GRAPHIQUE DE L'INHIBITEUR COMPETITIF
On s'est limité ici aux représentations de Michaelis-Menten et Lineweaver-Burk. L'inhibiteur compétitif se distingue facilement des autres inhibiteurs (voir tableau compararif des représentations graphiques des différents inhibiteurs).
VIDEO DE L'INHIBITEUR COMPETITIF
Inhibiteur compétitif. Version Ar
FIXATION DE L'INHIBITEUR SUR LA FORME D'ENZYME COMPLEXEE AVEC LE SUBSTRAT (ES). INHIBITEUR INCOMPETITIF
L'inhibiteur incompétitif ne peut se fixer que sur l'enzyme préalablement complexée au substrat (ES). Il est parfois appelé 'inhibiteur conditionnel'. Ce type d'inhibition est connu cinétiquement par une diminution parallèle de Ks (augmentation de l'affinité de E pour S) et de Vmax. Le type d'interaction est résumé dans la figure:
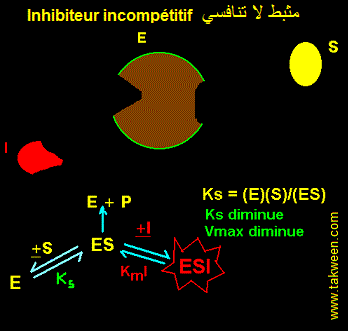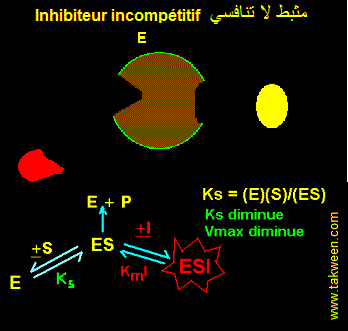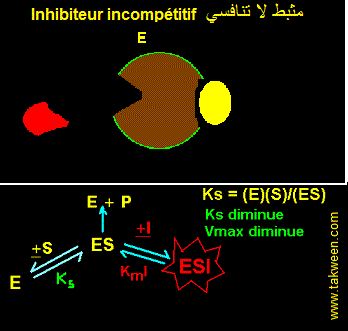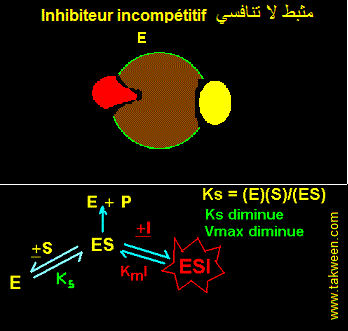
EQUATION DE VITESSE DE L'INHIBITEUR INCOMPETITIF
En partant des interactions E, S, La constante k3 caractérise ES ---> E + P. La vitesse v = k3.(ES).
t I, on déduit:
Ks = (E)(S)/(ES) et KmI = (ES)(I)/(ESI).
sachant que v = k3.(ES) et Vmax = k3.(ET), avec (ET) = (E) + (ES) + (ESI), v/Vmax = (E)/(ET)
v/Vmax = (ES)/(ET) = (ES)/[(E) + (ES) + (ESI)]. Sachant que (E) =
Ks.(ES)/(S) et (ESI) = (ES)(I)/KmI,
on aura: v/Vmax = (ES)/[Ks.(ES)/(S)
+ (ES) + (ES)(I)/KmI].
En divisant par (ES) on aura:
v = Vmax.1/[Ks/(S) + 1 + (I)/KmI]. La mise en facteur de (1 + (I)/KmI)
dans le dénominateur donne:

Vmax et Ks diminuent d'un même facteur (division par 1 + (I)/KmI) (plus de détails).
REPRESENTATION GRAPHIQUE DE L'INHIBITEUR INCOMPETITIF
On s'est limité ici aux représentations de Michaelis-Menten et Lineweaver-Burk. L'inhibiteur incompétitif se distingue facilement des autres inhibiteurs par une cinétique sous forme de droites parallèles.
VIDEO DE L'INHIBITEUR INCOMPETITIF
COMPARAISON DES INHIBITEURS
comparaison des différents inhibiteurs
EXERCICES SUR LES INHIBITEURS
Exercices sur inhibiteurs incompétitifs. Exemple de l'alpha glucosidase
PASSER UN CONTROLE NOTE ET COMMENTE SUR L'ENZYMOLOGIE

-Enzymologie-enzymes (exercices)
- QCM-Enzymes. Structure et fonction (bases)
- Hexokinase
- Coenzyme Atransférase
- Amine oxydase
- Inhibiteurs. Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Enzymologie. Examen-1
- Enzymologie. Examen-2
- Enzymologie. Examen-3
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase. Examen S5
- Phospholipase A2. Examen
- Carboxylestérase, PAL. Examen S5, 2013

CHAINE
YOUTUBE

Chaine Youtube (abonnement).
Plusieurs vidéos multilingues
LIVRES
+ DVD
Ouvrages
(livres) multilingues pour faciliter la transition Secondaire-Supérieur
(Ar, Fr) avec DVD + QCMs, Exercices:>
-Glossaire trilingues Français-Arabe-Anglais

- Livre 'Structures et Métabolisme des Sucres', Baaziz, 2018(+ DVD,
400 QCM):

-> Présentation
du livre
-> Afiche annonce du livre
- تحميل ملفات في مواضيع البيوكيمياء Téléchargement de fichiers en Biochimie