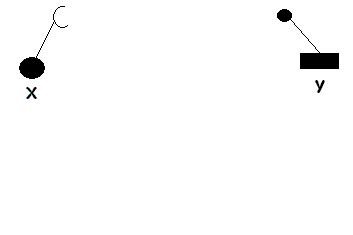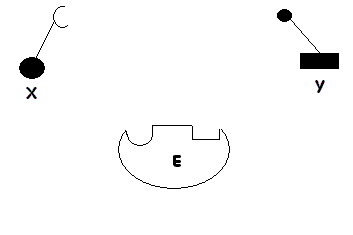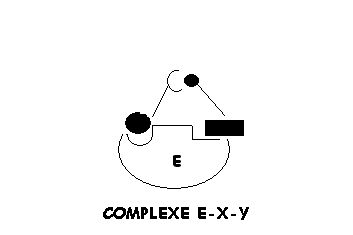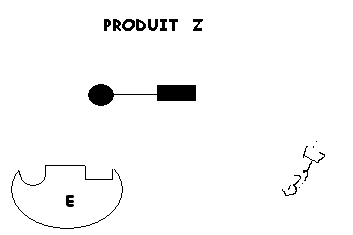
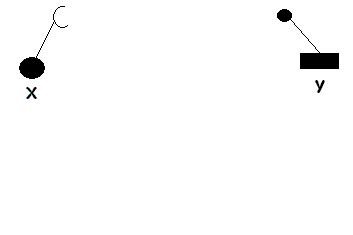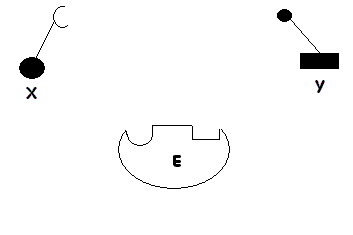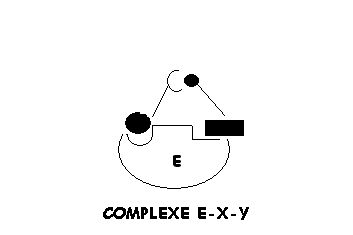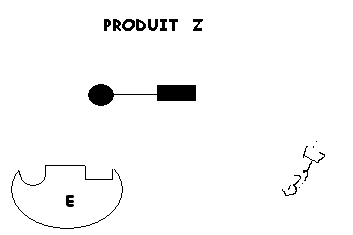
| French
|
Arabic
|
English
|
| Enzymes | إنزيمات | enzymes |
| Site actif | موقع نشيط | Active site |
| Triade catalytique | ثلاثية تحفيزية | Catalytic triad |
| Catalyse covalente | تحفيز تساهمي | Covalent catalysis |
Le mécanisme de catalyse biologique par les enzymes concernent l'effet de positionnement et de proximité, la catalyse acide-base, la catalyse covalente (chymotrypsine) et la catalyse métallo-dépendante.
La catalyse nécessite une énergie d'activation suffisante pour transformer un ou des substrat(s) en produits. les enzymes sont des catalyseurs biologiques qui réduisent l'énergie d'activation nécessaire pour qu'une réaction puisse se dérouler.
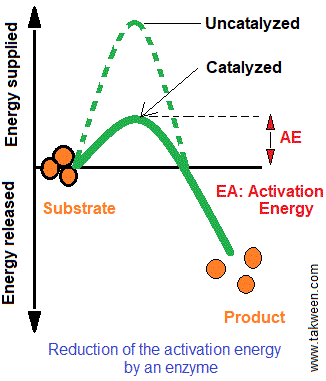
D'où vient l'énergie nécessaire pour réduire l'énergie d'activation de la réaction enzymatique ?
L'énergie provient de réactions chimiques entre le substrat et les groupes fonctionnels portés par l'enzyme, tels que les chaînes latérales d'acides aminés, les ions métalliques et les coenzymes. Les groupes fonctionnels enzymatiques augmentent la vitesse initiale de la réaction et diminuent l'énergie d'activation (en utilisant une voie de réaction à plus faible énergie). La deuxième source de production d'énergie nécessaire pour abaisser l'énergie d'activation provient des faibles interactions non covalentes entre l'enzyme et le substrat. Ainsi, les enzymes facilitent la formation d'espèces à l'état de transition au sein de la réaction et accélèrent la vitesse de la réaction d'un million de fois par rapport aux réactions non catalysées.
1. CATALYSE PAR EFFET DE POSITIONNEMENT ET DE PROXIMITE
Lors la catalyse
(transformation de substrats en produits), on peut imaginer que la transformation est précédée par un effet de positionnement et de proximité où des molécules X et Y en se fixant sur l'enzyme (E), se trouvent proches l'un de l'autre pour réagir et donner le produit C. Tout se passe comme si:
- Leurs concentrations étaient suffisament élevées pour que leur probabilité de rencontre soit très élevée.
- Les groupements réactifs des substrats activés étaient correctement positionnés pour réagir.
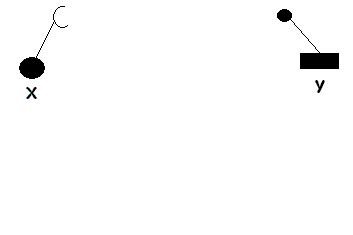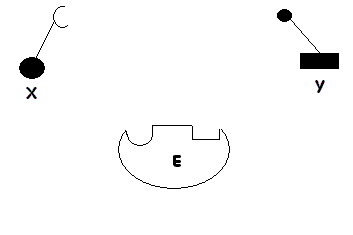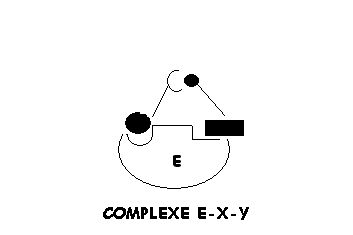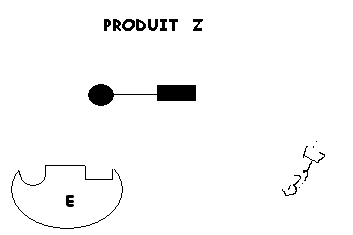
2. CATALYSE ACIDE-BASE
Chez les enzymes, on trouve trois grands types d'acides aminés impliqués dans une catalyse acide ou basique. Ils sont représentés par:
- Les résidus acides Aspartate ou Glutamate qui pourront donner un proton à pH 7,0 et sont négatifs à ce pH,
- les résidus basiques comme la Lysine ou l'Arginine qui captent un proton à pH 7,0 et sont positifs à ce pH
- l’Histidine qui peut jouer le rôle d'amphotère.
La connaissance des pK des chaines latérales de ces acides aminés est nécessaire pour comprendre de nombreux mécanismes.
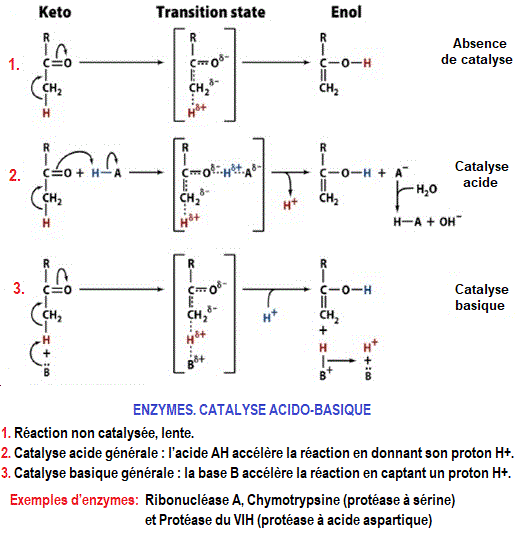
La catalyse acide-base générale est le mécanisme le plus courant de la catalyse enzymatique. L'accélération de la réaction résulte du transfert d'un proton. Ce proton peut provenir du couple imidazole de la chaîne latérale de l'histidine. L'activité catalytique des enzymes de ce type est largement influencée par le pH.
3. CATALYSE COVALENTE
Un simple attachement des substrats sur le site actif
par l'intermédiaire d'une liaison faible (L. hydrogène,...) ne peux pas mettre en jeu des énergies suffisantes pour fournir aux molécules de substrats la totalité de l'énergie d'activation de la réaction initiale. L'apport d'une telle énergie peut être réalisé par deux possibilités essentielles:
- Formation de liaisons covalentes Enzyme-Substrat
- Formation de complexes intermédiaires successifs où chaque étape possède une énergie d'activation relativement faible.
La catalyse covalente (Catalyse catalyse nucléophile) concerne essentiellement les réactions enzymatiques à plusieurs substrats (environ 20% des enzymes et toutes les enzymes qui catalysent un mécanisme à 2 substrats de type 'ping-pong'). Une trace du premier substrat est transférée à l'enzyme via la formation d'une liaison covalente enzyme-substrat (enzyme transitoire). Ensuite, la trace du premier substrat est transférée au second.
Formation de la triade catalytique:
La manière courante de produire des résidus nucléophiles pour la catalyse covalente consiste à utiliser la triade nucléophile-acide-base fournie par trois acides aminés appartenant à l'enzyme en tant que protéine. Ces résidus forment un réseau de transport de charge qui attire et active le résidu nucléophile qui attaque le substrat qui forme avec l'enzyme un intermédiaire covalent qui est ensuite hydrolysé pour libérer à nouveau l'enzyme. En général, la triade catalytique peut désigner n'importe quel groupe de trois acides aminés de l'enzyme qui fonctionnent ensemble et sont directement impliqués dans la catalyse. Parce que les enzymes se replient en formes tridimensionnelles complexes, les résidus de la triade catalytique peuvent être plus éloignés dans la structure primaire de l'enzyme, tout en étant rapprochés dans la structure tridimensionnelle.
Par exemple la triade catalytique de la protéase TEV (virus de la gravure du tabac), l'acide est représenté par l'acide aspartique, la base est représentée par l'Histidine et le nucléophile est représenté par la Cysteine.
Constituants d'une triade catalytique:
- Le nucléophile: Les principaux nucléophiles enzymatiques sont l'hydroxyle OH du groupe alcool de la sérine et le sulfhydryle SH du groupe thiol ou de l'ion thiolate S− de la cystéine. Inclure ces nucléophiles dans une triade catalytique accroît leur activité.
- La base: les triades catalytiques font intervenir une base qui polarise et déprotone le nucléophile afin d'accroître sa réactivité, car aucun acide aminé naturel n'est suffisamment nucléophile pour catalyser seul les réactions chimiques. En général, le résidu d'histidine joue le rôle de base dans les triades catalytiques
- L'acide: Le résidu acide sert à polariser le résidu basique. Il correspond généralement à un résidu d'aspartate ou de glutamate. Certaines enzymes peuvent se contenter d'une 'dyade catalytique', lorsque la composante acide n'est pas nécessaire pour la catalyse de certaines protéases à cystéine.
Exemples de triades catalytiques (dans l'ordre nucléophile-base-acide):
- Triade Ser-His-Asp chez la chymotrypsine
- Triade Cys-His-Asp chez les protéases à cystéine
- Triade Ser-His-His chez la peptidase du cytomégalovirus

La catalyse covalente appelée aussi catalyse nucléophile:
- Elle implique l'accélération de la vitesse par la formation transitoire d'une liaison covalente entre l’enzyme et un ou plusieurs substrats.
- L’enzyme modifiée devient ensuite un réactif avant de revenir à son état d’origine à la fin de la réaction.
La catalyse covalente concerne surtout les transférases. Les résidus les plus impliqués sont:
- Le groupe imidazole de l'His,
- le groupement thiol de la Cys,
- le groupement hydroxyle de la Ser.
Démonstration du caractère covalent de la liaison enzyme-substrat (ES):
Une fois le complexe ES stable est isolé, on le traite avec un agent dénaturant des protéines (détergents,
urée, guanidine, pH extrême,...). Si le substrat reste fixé à la protéine dénaturée, cela
signifie que la liaison E-S était covalente (QCM-liaisons)
1/ Télécharger une molécule de chymtrypsine à partir du site web: https://www.rcsb.org/pdb
2/ Etudier la structure de la protéine par le programme RasMol
La chymotrypsine est une protéase, qui catalyse la rupture de la liaison peptidique avec une préférence pour les acides aminés Tyr, trp, Phe et Leu (Acides aminés hydrophobes). Elle fait partie de la famille des sérine protéases, Ayant toute un site actif similaire (cavité hydrophobe). Elle est synthétisée sous une forme inactive par le pancréas. Celle ci donne la forme active dans l'intestin grêle.
La triade catalytique des protéases à sérine est constituée de l'aspartate 102 (D102) comme acide, l'histidine 57 (H57) comme base et de la sérine 195 (S195) comme nucléophile.
L'hydrolyse de substrats modèles par la chymotrypsine suggère une catalyse acide-base par un résidu imidazole.
Intermédiaire covalent de type acyl-enzyme: exemple de la chymotrypsine (protéases):
La réaction catalysée par la chymotrypsine se déroule en deux temps, l'acylation et la désacylation. L'intervention d'une molécule d'eau est iportante.
 |
 |
 |
 |
4. CATALYSE METALLO-DEPENDANTE
- Métalloenzymes possédant des ions métalliques fortement liés comme Fe2+, Fe3+, Cu2+, Zn2+, Mn2+ , Mo2+ ou Co2+.
Les ions métalliques participent à la catalyse de quatre façons majeures :
1) Dans la liaison des substrats afin de les orienter.
2) Facilitent les réactions d’oxydation-réduction par les changements réversibles de leur état d'oxydation.
3) Servir de catalyseur électrophile en stabilisant une charge négative sur un intermédiaire de la réaction. C'est le cas des kinases.
4) Créer un nucléophile en augmentant l’acidité d’une molécule voisine ex : la coordination par le métal rend les molécules d’eau plus acides et donc une source OH- à des pH neutres. C'est le cas de l'anhydrase carbonique
- Enzymes activées par des ions métalliques faiblement liés en solution comme Na+, K+, Mg2+, ou Ca2+.
Exemple de Catalyse métallo-dépendante. Anhydrase carbonique.
1. Coordination d’une molécule de zinc par trois histidines et une molécule d'eau. L'ionisation de la molécule d'eau est facilitée par catalyse base générale impliquant le résidu histidine-64 voisin.
2. Attaque nucléophile par le OH- du CO2 et la conversion en HCO3-.
3. Régénération du site catalytique par la liaison d'une autre molécule d'eau avant la libération de HCO3- pour former un intermédiaire : complexe de zinc penta coordonné puis libération du HCO3-.

Question 1.
Remplir le vide par le mot convenable dans la phrase: les ......... catalysent la réaction par acceptation de protons:
(!acides)(bases)(!enzymes)
Question 2.
Choisir l'information FAUSSE concernant la catalyse acide-base:
(!Les bases catalysent la réaction en acceptant un proton)(!Les bases augmentent la vitesse de réaction en augmentant le caractère nucléophile du groupe attaquant)(La catalyse acide-base rend les réactifs proches les uns des autres)(!La catalyse spécifique des ions hydroxydes de réaction dans l'eau est un exemple de ce type de catalyse)
Question 3.
In covalent catalysis, the covalent bond is usually formed by the reaction of a nucleophilic group on the catalyst (enzyme) with an electrophilic group on the substrate.
(True)(!False)
Question 4.
Which of the following is not involved in covalent catalysis ?
(Acidic side chain of the enzyme which catalyze the reaction by proton transfer )(!Electron rich nucleophilic function group of amino acid side chain in the enzyme )(!Electron deficient electrophilic portion of substrate)(!transient formation of enzyme-substrate covalent bond)
Question 5.
The catalytic triad of most Serine proteases contains an Asp, His and Ser residue. Which of the following is true?
(The Ser residue is used in a nucleophilic attack on the peptide bond.)(!The Asp residue is responsible for the substrate specificity of Trypsin.)(!The His residue is responsible for the substrate specificity of Trypsin.)(!The Asp residue is used in an acid catalyzed attack on the peptide bond.)
Question 6.
The nucleophile in serine proteases is:
(Ser.)(Water.)(!Asp.)(!His.)
Question 7.
The nucleophile in serine proteases is activated primarily by:
(!Ser.)(!Water.)(!Asp.)(His.)
Détails des réponses:
Question 1: Les bases catalysent la réaction en acceptant un proton, tandis que les acides en donnant un proton. Les enzymes sont des catalyseurs biologiques qui augmentent la vitesse de la réaction, sans subir aucune modification.
Question 2: FAUX: 'Pour rendre les réactifs proches les uns des autres'. Ceci est vrai pour la catalyse par effet de positionnement et de proximité, et non pour la catalyse acido-basique. Les informations suivantes sont vraies pour la catalyse acide-base :
• Les bases catalysent la réaction en acceptant un proton, tandis que les acides en donnant un proton.
• Les bases augmentent la vitesse de réaction en augmentant le caractère nucléophile du groupe attaquant.
• La catalyse spécifique des ions hydroxydes de réaction dans l'eau est un exemple de ce type de catalyse.
Question 4: In covalent catalysis , Nucleophilic group (group can donate electrons) usually at enzyme attacks electrophilic group (group can accept electrons) which result in formation of transient covalent bond. Reminder: A nucleophile is an atom or functional group with a pair of electrons (usually a non-bonding, or lone pair) that can be shared. A nucleophile shares its lone pair of electrons with an electrophile (an electron-poor atom other than a hydrogen, usually a carbon).
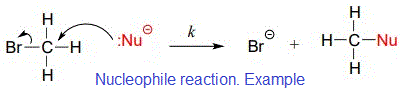
5. FACTEURS INFLUENCANT LA REACTION ENZYMATIQUE
- Effet de la température
Toute variation de température agit sur un système enzymatique par deux effets indépendants qui doivent être considérés séparément : l’action sur les constantes cinétiques de la réaction et l’action dénaturante sur la protéine enzymatique entraînant son inactivation.
La vitesse des réactions chimiques est fonction de la température.
Pour des températures comprises entre 10 et 60°C environ, une réaction enzymatique (comme toute réaction chimique) voit sa vitesse de réaction augmenter.
Chaque enzyme est caractérisée par une température optimale pour laquelle son activité enzymatique est maximale.
Quand la température augmente au-delà de 40°C, il se produit une inactivation (dénaturation ) progressive de la protéine enzymatique.
A températures élevées, fluctuations importantes de la structure 3D de la protéine avec perte de la structure tridimensionnelle (affectant le site actif) et entraînant une perte de fonction, d'où une chute de l'activité enzymatique. Il en résulte une dénaturation thermique, souvent irréversible.

- Effet du pH
Les enzymes sont des protéines constituées d’acides aminés pouvant porter des fonctions chimiques sensibles aux variations de pH. Ces fonctions chimiques peuvent se protonner ou se déprotonner selon le pH du milieu dans lequel se trouve l’enzyme.

Le pH peut agir sur plusieurs facteurs :
- L’ionisation des résidus de l’enzyme et du substrat et/ou du produit.
- La structure tertiaire des protéines et donc la stabilité de l'enzyme.
Liens utiles:
- إنزيمات. ميكانزمات التحفيز الإنزيمي- Enzymes. Catalysis mechanisms
- Enzymologie-enzymes (exercices)
- QCM-Enzymes. Structure et fonction (bases)
- Hexokinase
- Coenzyme A transférase
- Amine oxydase
- Inhibiteurs. Applications
- QCM-Inhibiteurs-2.
- Enzymologie. Examen-1
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase. Examen S5
- Phospholipase A2. Examen
- RETOUR A: ENZYMES. CATALYSEURS BIOLOGIQUES
Ouvrages de la préparation de la transition Secondaire-Supérieur

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
BIOCHIMIE. TP CONSIGNES (Vidéos)
Chaine
Youtube (abonnement). Plusieurs vidéos multilingues

ANNONCES, INFORMATIONS
Congrès, Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo annonces
CONCOURS:
Concours de Pharmacie