
En enzymologie, les enzymes sont associées aux activités du métabolisme. Les modulations (régulations) enzymatiques se font à travers des isoenzymes et sont caractérisées par des paramètres Km et Vmax. La spécificité (efficacité) enzymatique peut être évaluée par Vmax/Km. Das ces exercices, on aborde les notions d'activité molaire et l'efficacité catalytique (catalyic efficiency) avec des applications sur la glucokinase et la phosphatase alcaline
(https://www.ac-nice.fr/):
Une enzyme purifiée de masse molaire 800 000 g/mol, catalyse la transformation de S (substrat) en P (produit) avec un Km = 10-5 M. La solution d' enzyme pur, à la concentration de 150 mg/ml, est capable, si la concentration en S est de 1 x 10-2 M, de catalyser la réaction à une vitesse de 3 x 10-5 M/min.
Donnez la définition de l'activité molaire et son unité. Est-il possible de calculer l'activité molaire de l'enzyme décrite ici ? Si oui, justifiez votre réponse et calculez la.
Réponse
L'activité
molaire (AM) d'une enzyme se calcule uniquement si l' enzymeest pure et si on se place en conditions saturantes de substrat (v = Vmax).
AM = nombre de moles de produit formés/min/mole d' enzyme.
calculer AM car la solution d' enzyme est pure et [S]= 1 x 10-2
M>>Km =1 x 10-5 M (1000 fois supérieure) et donc
V = 3 x 10-5 mol de P/L/min = Vmax !
AM = Vmax / nombre de mole d' enzyme.
L'enzyme catalyse la transformation de 3 x 10-5
mol de P/min pour 1 litre de milieu réactionnel. Or la concentration de l'enzyme est de 150 mg/ml donc dans 1 litre on a : 150 x 10-6 x 1000 = 0,15 g d'enzyme.
Connaissant son poids moléculaire, on peut en déduire le nombre de moles : 0,15 / 8 x 10 5 = 1,875 x 10-7 mole d'enzyme
dans un litre de milieu réactionnel. D'où AM = 3 x 10-5/
1,875 x 10-7= 160 L/min.
Pour calculer une activité molaire, il faut : 1) Etre en conditions optimales de mesure de la vitesse de réaction (conditions saturantes en substrat ([S]>>KM) où V = Vmax et 2) Avoir une solution pure d' enzyme.
Il faut connaître la Vmax pour calculer l'activité molaire.
Or [S] =1 x 10-2 M >> Km= 1 x 10-5
M (facteur 1000) donc on est en conditions saturantes de S. Cela signifie
que la vitesse mesurée à cette concentration en S est la
Vmax. Donc Vmax = 3 x10-5 M/min.
L’efficacité catalytique d’une enzyme est en relation avec l’activité avec laquelle elle se fixe à ses substrats et la vitesse de conversion des substrats en produits. L'efficacité catalytique rend compte à la fois des évènements de liaison et de ceux de catalyse (spécificité et efficacité). Elle indique la variation de la vitesse en fonction de la fréquence de combinaison de l'enzyme avec le substrat. L’efficacité catalytique est mesurée par : kcat/KM (exprimé en M-1.s-1). Parfois on calcule le rapport Vmax/Km. Elle indique la variation de la vitesse en fonction de la fréquence de combinaison de l’enzyme avec le substrat. La valeur de kcat/KM, représente la capacité globale de l’enzyme à convertir le substrat en produit. Plus kcat/KM est élevée, plus l’enzyme est efficace.
Exercice (source: https://xray.bmc.uu.se)
Admit: E, an enzyme, S, a substrate and P, a product. The enzyme-catalysed reaction is:
| k1 | kcat | |
| E + S |
===> <=== |
ES ===> E + P |
| k-1 |
a/
Ks, the [ES] dissociation constant, is frequently equated with Km.
However, there is usually a difference between those values. Why?
Under what conditions are Ks and Km equivalent?
b/ Why are kcat/Km values useful to describe the specificity, or preference for different substrates, of an enzyme?
Answer:
a/ Km = (k-1 + kcat)/k1, Ks = k-1/k1, Km = Ks, when kcat
<< k-1
b/The kcat/Km for any given substrate tells us about
the behavior of the reaction when the concentration of that substrate
is low compared to Km (the usual situation in the cell). Suppose that
two different substrates, A and B, are competing for binding and catalysis
by the same enzyme. When the concentration of A and B are equal, the
ratio of their conversion to product by the enzyme is equal to the
ratio of their kcat/Km values. We can figure out why this is so: If
the substrate concentration is low, the overall reaction is limited
by the encounter of substrate S with the enzyme E, with the rate equation:
v0 = (kcat/Km) [E]tot [S]
In the case above [S] = [A] = [B], and so v0A/v0B = (kcat/Km)A / (kcat/Km)B
kcat/Km is therefore often called the the specificity constant.
To see that the rate equation is v0 = (kcat/Km) [E]tot [S] for low substrate concentrations, start from the MM equation: v0 = Vmax [S] / (Km + [S])
For [S] << Km this reduces to v0 = (Vmax / Km) [S]
Remember that Vmax = kcat [E]tot, so v0 = (kcat / Km) [E]tot [S] for
low [S]
Start from the steady state assumption: k1 [E] [S] = (k-1 + kcat)
[ES] (1)
Remember that the overall velocity of the reaction is given by v0 = kcat [ES] (2)
From (1) we get the concentration of ES: [ES] = k1 [E] [S] / (k-1 + kcat) = [E][S] / Km
Insertion of [ES] into (2) then gives v0 = (kcat/Km) [E] [S] (3)
This form of the equation is of less practical value, however, since [E] will vary with [S] in a way that also depends on the Km for S:
[E] = [E]tot - [ES]
[ES] = [E]tot [S] / (Km + [S])
[E] = [E]tot - [E]tot [S] / (Km + [S]) =
[E]tot ( 1 - [S] / (Km + [S]) ) =
[E]tot ( Km + [S] - [S] ) / (Km + [S]) ) =
[E]tot Km / (Km + [S])
Inserting this expression for [E] into equation (3) above then gives back the normal form of the MM equation.)
La phosphatase alcaline est une enzyme hydrolysant les esters phosphoriques comme l'ATP ou le glucose 1-phosphate pour libérer de l'acide phosphorique libre. Le substrat le plus couramment utilisé pour doser l'activité de cette enzyme est le phosphate de p-nitrophénol. Les paramètres cinétiques pour différents substrats essayés sont résumés dans le tableau suivant:
| substrat | Km | Vmax (µmole/ min. ml) |
| UDP | 0,025 | 115 |
| ATP | 0,030 | 121 |
| AMP | 0,032 | 124 |
| Glucose 6- phosphate | 0,021 | 116 |
| Glucose 1- phosphate | 0,024 | 111 |
Déterminer la spécificité de la phosphatase alcaline
Réponse
La
spécificité est donnée par le rapport kcat/Km. Comme on ne dispose pas ici de kcat, on peut comparer les Vmax/Km. Ce rapport varie entre 3875 U/ml.mM pour l'AMP et 5523 U/ml.mM pour le Glucose-6-phosphate, en passant par 4033 U/ml.mM et 4600 U/ml.mM. Ces variations relativement sont en faveur d'une spécificité faible. En Anglais le rapport Vmax/Km est désigné 'catalytic efficiency'.
Rappel: kcat est une constante de vitesse du premier ordre (unité
s-1). C'est une fréquence avec laquelle l'enzyme établit l'acte catalytique (nombre de fois par seconde) lorsqu'il est saturé par le substrat. 1/kcat est la durée, en s de l'acte catalytique (temps requis pour convertir 1 molécule de substrat en produit). kcat donne la mesure
de l'efficacité de la catalyse par l'enzyme (seconde-1) ou 'Turn-over' de l'enzyme.
[Et] connue, Vmax = kcat [Et], donc kcat = Vmax/[Et]
L'apparition
du diabète MODY-2 (Maturity-Onset Diabetes of the Young, ou diabète de type adulte chez le jeune, est due à une anomalie de la glucokinase, résultant d'une mutation du gène de la glucokinase localisé sur le chromosome 7, hyperglycémie très précoces (à jeun, entre 1,10 et 1,40 g/l (+/- intolérance au gluten). La glycémie reste inchangée pendant plusieurs décennies.
L'étude cinétique de cette enzyme purifiée à partir de cellules d'un individu sain et d'un individu malade, en faisant varier la concentration en substrat (S en mM) (ici, le glucose) et en mesurant la vitesse enzymatique initiale (vi en mM/min), permis d'avoir les vitesses suivantes (les mesures sont réalisées dans un volume réactionnel final de 1 ml).
 |
 |
 |
 |
Glucokinase (suite)
| S (mM) | 0,5 | 1,0 | 1,5 | 2,0 | 3,0 | 4,0 | 8,0 | 16,0 |
| Individu malade, vi (mM. min-1) | 0,12 | 0,14 | 0,21 | 0,30 | 0,51 | 0,53 | 0,60 | 0,60 |
| Individu sain, vi (mM. min-1) | 0,45 | 0,75 | 0,90 | 1,20 | 1,70 | 2,10 | 2,40 | 2,40 |
1/ Rappeler
les spécificités métaboliques et les localisations tissulaires de la glucokinase et de l'héxokinase de l'Homme.
2/Tracer les représentations de Lineweaver-Burk de la cinétique de la glucokinase pour les deux individus. Déterminer les constantes Km et Vmax.
3/ Comparer l'efficacité catalytique de la glucokinase chez les deux individus.
Réponse
Pour rappel, le diabète MODY (Maturity Onset type Diabetes of the Young) est un diabète situé entre le diabète de type I (insulino-dépendant) et le diabète de type II (non-insulino-dépendant). Selon
les auteurs, le diabète MODY est classé parmi les diabètes de type II, ou mis à part.
2/ Représentation 1/v = f(1/(S)) pour la glucokinase chez un individu sain et un autre malade
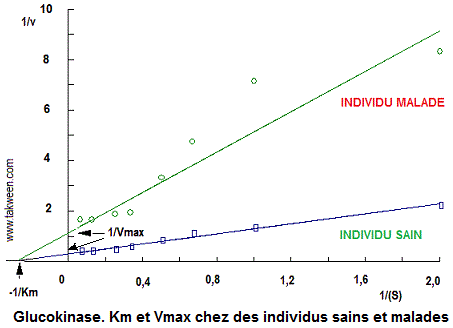
| Km (mM) | Vmax (mM. min-1) |
Vmax/ Km (mM. min-1. mM-1 |
|
| Individu malade | 3,53 | 0,88 | 0,25 |
| Individu sain | 3,28 | 3,32 | 1,01 |
3/
L'efficacité catalytique de la glucokinase (Vmax/Km) de l'individu
sain est 4 fois plus supérieure à celle de l'individu malade.
Cependant l'affinité de l'enzyme pour le glucose est presque la
même pour les deux individus.
Lien utile: Glucokinase,
Hexokinase, béta-galactosidase et phospholipase A2. Examen (pdf)
- Mécanisme de catalyse à plusieurs substrats. Moyens d'étude
- Enzymologie-enzymes (exercices)
- QCM-Enzymes. Structure et fonction (bases)
-
Hexokinase
- Coenzyme Atransférase
- Amine oxydase
- Inhibiteurs. Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Phospholipase, Allostérie
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase. Examen S5
- Phospholipase A2.Examen
- ADP-Glucose pyrophosphorylase
et Pectine méthylestérase. Examen S5
- Comparaison Hexokinase et Glucokinase. Exercice
- إنزيمات، إنزيمولوجيا - Enzymes, Enzymology
Ouvrages de la préparation de la transition Secondaire-Supérieur

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
Takween. Supports
-Glossaire trilingues Français-Arabe-Anglais


Chaine
Youtube (abonnement). Plusieurs vidéos multilingues

Congrès, Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo annonces
CONCOURS:
Concours de Pharmacie
-
وحدات مسلك
علوم الحياة
Modules de la filière Sciences de la vie -
الولوج إلى الجامعة
ACCES A L'UNIVERSITE
BIOCHIMIE. TP CONSIGNES (Vidéos)