L'hémoglobine (خضاب ,هيموغلوبين)
est une protéine du transport de l'oxygène constituée de deux chaines (alpha et béta) avec une structure quaternaire alpha2-béta2.
La mutation
de l'cide aminé Glu6 en Val6 sur la chaîne béta, entraine un disfonctionnement dans le transport de O2 se traduisant par une anémie, appelée anémie falciforme (Sickle cell
disease, en anglais) ou drépanocytose.
Hémoglobine. Exercice
فقر الدم المنجلي (Anémie falciforme)، مرض وراثي يتجلى في تغيير شكل الكريات الحمراء (Globules rouges, hématies) مما يأثر على الوظيفة التنفسية. أصبح من الممكن الكشف المبكر عن هذه التشوهات من خلال تحليل الخضاب الدموي أو الهيموغلوبين (Hémoglobine) بتقنية الكهرتهجير (Electrophorèse) أثبتت دراسة خضاب شخصين، عادي بخضاب يسمى HbA و مريض بخضاب يلقب ب HbS (Sickle-cell disease, en anglais)، التغيرات المتمثلة في الوثيقة التالية
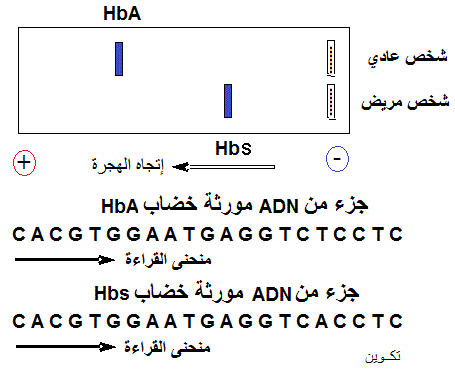
1- حلل هذه النتائج بخصوص سبب مرض فقر الدم المنجلي.
2- من المعروف أن الخضاب يتكون من سلسلتين ألفا (A) و بيتا (B) توجد كل واحدة منهما في
نسختين مع بنية رباعية في شكل A2B2. توصل البحث إلى كون الاختلاف بين نوعي الخضاب
الدموي HbA و HbS يهم السلسلة بيتا وحدها.
كما تمت معرفة سلسلة النيكليوتيدات المكونة لمورثة (Gène) كل نوع من الخضاب المحمولة
فوق الحمض النووي الريبوزي ناقص الأكسيجين (Acide désoxyribonucléique, ADN) (أنظر الوثيقة).
إستعانة بوثيقة الرمز الوراثي:
- استنبط سلسلة ARN الرسول (ARNm) المناسبة
لكل جزء من المورثة.
- حدد سلسلة الأحماض الأمينية التي تنتج
عن ترجمة ARNm المناسب لكل نوع من الخضاب.
- حدد نوعية الطفرة التي ينتج عنها فقر الدم
المنجلي
- إستنادا إلى بنية الخضاب، ناقش التغيرات
البنيوية التي يمكن أن تنتج عن الطفرة

الجواب
1-
أظهرت تقنية الكهرتهجيرالتي تعتمد على خاصية الشحنة الكهربائية في فرز الجزيئات،
أن خضاب HbA للشخص العادي يمتازبهجرة أسرع من نظيره HbS
للشخص المريض، حيث يبقى بروتين HbS متأخرا أثناء
هجرته نحو المصعد (Anode, +). يفيد هذا أن بروتين
HbA يضم أحماضا أمينية قطبية (Acides aminés polaires) سالبة الشحنة الكهربائية أكثر ما
هو موجود في الخضاب HbS. و أن ظهور مرض فقر الدم يمر بطفرة تستبدل حمضا أمينيا
أو عدة أحماض سالبة الشحنة الكهربائبة
(حمض الأسبارتيك (Asp) و حمض الكلوتاميك (Glu)) بأحماض أمينية موجبة أو بدون شحنة، أي لا
قطبية هيدروفوبية (Acides aminés apolaires, hydrophobes). يعود إذا مرض فقر الدم إلى خلل في بنية الخضاب الدموي HbS.
Lien utile: Eléctrophorèse de l'hémoglobine
2-
إنطلاقا من أجزاء ADN المورثات لكل من خضاب HbA و خضاب HbS، يمكن استخراج ARNm لكل بروتين:
- ARNm خضاب HbA هو: GUG CAC CUU ACU CCA GAG GAG (منحنى
القراءة من اليسار إلى اليمين)
متتالية الأحماض الأمينية الناتجة عن ترجمة ARNm لخضاب
HbA هي: Val-His-Leu-Thr-Pro-Glu-Glu (منحنى
القراءة من اليسار إلى اليمين)
- ARNm خضاب HbS هو: GUG CAC CUU ACU CCA GUG GAG
(منحنى القراءة من اليسار إلى اليمين)
متتالية الأحماض الأمينية الناتجة عن ترجمة
ARNm لخضاب HbS هي: Val-His-Leu-Thr-Pro-Val-Glu
(منحنى القراءة من اليسار إلى اليمين)
- نوعية الطفرة في خضاب HbS تتعلق بحلول
الحمض الأميني Val محل الحمض
الأميني السادس، أي Glu. كل هذا كان نتيجة
لاستبدال نكليوتيد واحد، فقط ب ADN مورثة
خضاب HbS للشخص المريض بفقر الدم، أي حلول
A محل T.
يوجد Glu فوق السلسلة بيتا (B) للخضاب كما يمكن
مهاينته في الصفحة
الخاصة للهيموغلوبين (Hémoglobine).
- التغيرات البنيوية التي يمكن أن تنتج
عن الطفرة تتعلق بكون الفالين (Val)
حمض أميني نافر للماء وقد يدخل في روابط
هيدروفوبية مع أحماض أمينية هيدروفوبية أخرى،
مما ينعكس سلبا عن البنية الوظيفية للخضاب.
هكذا، تبين أن Val6 لسلسلة بيتا من جزيئ معين
من الخضاب ينجذب مع Phe85 و Leu88 لسلسلة ألفا
لجزيئ آخر من الخضاب ليعطي تكثل (Aggrégation)
و نقصان في ذوبان الخضاب ليترسب على شكل
إبر مكونة من سلسلات طويلة مما يؤدي إلى
تشوه شكل الكريات الحمراء لتسد الشعيرات
الدموية الرقيقة منتجة فقر الدم.
Réponses (suite)

En cas
de drépanocytose, Les deux molécules d'hémoglobine deviennent adhérentes en un point voisin de l'acide aminé Val6 de la chaîne béta de HbS, hémoglobine se distinguant par l'insolubilité de sa forme désoxygénée. La valine est un acide aminé hydrophobe qui remplace l'acide glutamique (Glu6) dans la mutation. Il se forme un 'point de collage' entre la chaîne alpha d'une autre molécule (à travers les acides aminés hydrophobes Phe85 et Leu88) et la valine 6 d'une chaîne bêta
de la seconde molécule Hb mutée. Cette liaison répétitive
est responsable de la polymérisation des molécules d'HbS et
de la déformation des hématies.
Le gène codant pour la chaîne béta porteuse de la mutation
est porté par le chromosome 11. Lallèle S de ce gène
est responsable de l'anémie falciforme. Il est codominant avec
l'allèle A. C'est a dire que les deux allèles s'expriment
chez l'hybride (hétérozygote). Néanmoins, les symptômes
restent absents tout en possédant des hématies falciformes.
La forme homozygote est (génotype SS) est la plus douloureuse.
Chez l'hétérozygote (SA), les globules rouges ne contiennent
pas nécessairement un mélange en proportions égales
d'HbA et d'HbS.
VIDEOS HEMOGLOBINE
Hémoglobine. Vidéo Ar:
Hémoglobine. Structures normale et affectée par la drépanocytose, version Fr
Une autre manière de détection de la drépanocytose. Disparition d'un site de restriction de l'enzyme de restriction Bsu I
La drépanocytose est due à une mutation ponctuelle au niveau du sixième codon du gène codant pour la chaine ß de l'hémoglobine ; il s'agit d'une substitution A->T changeant un acide aminé Glutamate (GAG) en Valine (GTG). Cette mutation conduit à la suppression d'un site de l'enzyme de restriction Bsu I (figure ci dessous). Il est donc possible de détecter la présence ou l'absence de la mutation par l'utilisation de cette enzyme. En pratique, la région contenant ce site de restriction est amplifiée par PCR à partir de l‘ADN génomique du patient à tester. Le produit de PCR est ensuite mis en présence de l'enzyme Bsu I. Les produits de digestion sont séparés sur un gel d'électrophorèse afin de détecter les fragments d'ADN selon leurs tailles. Dans le cas où la mutation est présente (allèle ßS), le site de restriction est supprimé et le fragment d'ADN est donc plus long (344 pb).
Un second site de restriction Bsu I, constant, sert de contrôle de digestion : l'absence du fragment constant de 100 pb ou la présence d'un fragment de taille inattendue signifie que l'enzyme de restriction n'a pas fonctionné correctement.
 |
 |  |
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Actions takween pour
la promotion de la culture scientifique et la réussite de la transition
Lycée-Université
تكوين. دعم الثقافة العلمية و مواكبة الانتقال
من الثانوية إلى الجامعة
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.

Takween. Supports
-Glossaire trilingues Français-Arabe-Anglais


Chaine
Youtube (abonnement). Plusieurs vidéos multilingues
 Enseignements par semestres
Enseignements par semestres
Congrès, Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo annonces
CONCOURS
- Concours de Médecine

- Concours d'accès aux Etudes de Médecine dentaire
- Concours de pharmacie