


------> Télécharger le polycopié TP
Le dosage des protéines par la méthode de Lowry rentre dans l'étude quantitative des protéines. Il s'agit d'un dosage colorimétrique. Le dosage se fait à travers une gamme étalon, réalisée à l'aide de quantités connues de l'albumine de sérum bovin (SAB).
Dans
le sang, le taux des protéines sériques est constant. Une variation de ce taux renseigne sur une défaillance fonctionnelle de l'organisme. Aussi, une variation dans des différents types de protéines sériques est une conséquence d'une anomalie pathologique aigue ou chronique. De ce fait, les aspects quantitatif et qualitatif des protéines sériques d'un individu renseignent bien sur l'état de sa santé.
Comme estimés par électrophorèse sur acétate de cellulose, les taux normaux des différentes protéines sériques de l'Homme sont:
60% (52%-67%).
Globulines : 40%.
Les globulines se répartissent selon:
- alpha;1-Globulines: 2,4-4,6%
- alpha;2-Globulines: 6,6-14,0%
- beta;-Globulines : 9,0-15,0%
- gamma;-Globulines: 9,0-21,0%
Pour déterminer la concentration totale de protéines dans un mélange complexe par spectrophotométrie d'absorption,
des méthodes colorimétriques sont souvent employées. Ces méthodes sont basées sur la réaction d'agents
chromophores avec les liaisons peptidiques ou avec certains acides aminés des protéines. Cette réaction donne naissance à une coloration (dans le visible) dont l'intensité (l'absorbance (A) ou densité optique (DO)) est directement proportionnelle à la concentration de la protéine. Les méthodes colorométriques les plus utilisées pour doser les protéines sont celles de Biuret, Lowry et Bradford.
Méthode colorimétrique de dosage par la réaction de Biuret
Gornall et al. (1949) J. Biol. Chem. 177, 751). En milieu alcalin, les ions cuivriques se lient par coordination aux atomes d'azote des liaisons peptidiques des peptides et protéines. La couleur rose du complexe formé se superpose à la couleur bleue de la solution cuivrique. La coloration obtenue est violacée.
Le dosage est réalisé en ajoutant le réactif de biuret, composé de cuivre (réactif de Gornall, composé de:
1/ Sulfate de cuivre, qui donne la coloration bleu du réactif due aux ions cuivre.
2/ Solution d'hydroxyde de sodium (soude) à 0,2 mM, qui rend le milieu basique.
3/ Tartrate double de sodium et de potassium, qui chélate (piège) les ions Cu2+ et évite leur précipitation en milieu basique sous forme d'hydroxyde de cuivre Cu(OH)2 insoluble.
4/ Iodure de potassium, pour éviter la réduction des ions cuivriques avant le dosage).
En milieu alcalin, les ions cuivriques se lient par coordination aux atomes d'azote des liaisons peptidiques des peptides et protéines.
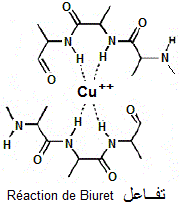
Ce complexe est d'autant plus violet (ou mauve) que la concentration en protéines est élevée. La longueur d'onde d'absorption du complexe est 540 nm. Un temps d'attente d'environ 30 min est nécessaire pour le développement de la couleur.
La méthode de Biuret est utilisée pour des concentrations en protéines comprises entre 1 mg/ml et 20 mg/ml.L'ammoniac et certaines amines peuvent interférer avec ce dosage (eg. tampon TRIS, sels d'ammonium sulfate). Cette méthode n'est pas non plus utilisable pour le dosage des glycoprotéines. Ceci rappelle la réaction de la liqueur de Fehling uttilisée
dans l'identification des sucres réducteurs et qui, elle aussi, utilise le cuivre. C'est pour cela qu'on recommande une déprotéinisation préalable à l'identification des sucres réducteurs d'une solution.
Méthode colorimétrique de dosage de Folin-Ciocalteu
Cette technique a été développée par Folin, Ciocâlteu et Denis. Ce dosage utilise le réactif de Folin (mélange de tungstate de sodium et de molybdate de sodium en solution dans de l'acide phosphorique et de l'acide chlorhydrique) qui réagit spécifiquement avec les acides aminés aromatiques. Il donne une coloration bleue qui absorbe la lumière à une longeur d'onde égale à 750 nm. La méthode de Folin-Ciocalteu est utilisée pour le
dosage des protéines avec des concentrations comprises entre
0,1 mg/ml et 1 mg/ml.
Dosage des protéines sériques par la méthode de Lowry
قياس بروتينات مصل الدم بطريقة لاوري
(Lowry et al., 1951, J. Biol. Chem. 193, 265.)
Lowry et al. (1951) J. Biol. Chem. 193, 251. Le réactif de Folin (acides phosphotungstique et phosphomolybdique) fut proposé en 1922 par Wu pour le dosage des protéines, car il donne une coloration
bleue avec certains acides aminés tels que la tyrosine (Tyr) le tryptophane (Trp) et la cystéine (Cys).
En 1951, Lowry et ses collaborateurs rendirent le dosage plus sensible
et moins tributaire de la teneur en tyrosine et tryptophane en effectuant
d'abord un pré-tratement cupro-alcalin des protéines
à doser, s'inspirant de l'ancienne méthode de biuret (complexation
du cuivre avec les liaisons peptidiques donnant une coloration violette
absorbant la lumière à 540 nm). Les ions Cu+ et
les radicaux du Trp, Tyr et Cys réduisent le complexe acide phosphotungstique/acide
phosphomolybdique (couleur jaune) contenu dans le réactif Folin-Ciocalteau
(Na2MoO4 + Na2WO4 + H3PO4), produisant ainsi une couleur bleue
(Cu+ + (F-C)ox ---> Cu2+ + (F-C)red)
Remarque: En général, l'absorbance est mesurée
à des longueurs d'ondes entre 500 nm et 750 nm où 500 nm est considéréee pour le dosage de fortes concentrations en protéines, alors que 750 nm est adoptée pour le dosage de faibles concentrations en protéines.
Le traitement cupro-alcalin rappelle la réaction de biuret, utilisée uniquement quand les concentrations en protéines sont élevées (1-20 mg/ml). Cependant, la méthode de Lowry permet de déterminer les concentrations en protéines comprises entre 0,05 mg/ml et 0,1 mg/ml. Un temps d'incubation
d'environ 30 min est nécessaire pour le développement
de la couleur bleue. Les interférents avec ce dosage sont: K+,
Mg2+, EDTA, phénols, détergents, agents réducteurs.
Réactifs
- Réactif A: Na2CO3
- 2% dans NaOH 0,1 N.
- Réactif B: tartrate de Na et K à 2% dans l'eau.
- Réactif C: CuSO4 5 H2O à 1% dans l'eau
- Réactif D: mélange constitué de 96 ml de réactif
A, 2 ml de réactif B et 2 ml de réactif C (préparé
juste avant l'emploi).
- Réactif E: réactif de Folin-Ciocalteu dilué au
1/3.
- Solution saturée de sulfate d'ammonium ((NH4)2SO4).
- Solution étalon de l'albumine bovine du sang à 0,1 mg/ml
(BSA).
- Solution F : sérum de lapin dilué 100 fois (concentration
protéique inconnue).
Mode opératoire
Dosage des protéines sériques
totales (TP)
- Diluer la solution F 20 fois, sachant qu'on utilisera 1 ml de cette
solution nouvelle (solution G) pour doser les protéines.
- Dosage des globulines sériques
Les globulines sériques sont séparées des albumines
par précipitation au sulfate d'ammonium (relargage). Elles précipitent
à 50% de saturation (voir précipitation
des protéines par le sulfate d'ammonium)
- Dans un tude de centrifugation maintenu dans la glace, introduire
5 ml de solution F.
- Ajouter goutte à goute, 5 ml d'une solution saturée
en sulfate d'ammonium ((NH4)2SO4) tout en agitant lentement le tube
maintenu dans la glace. Laisser précipiter 20 minutes.
- Centrifuger à 9000 g pendant 15 minutes. Le précipité
contient les globulines. Les albumines restent dans le surnageant.
- Eliminer le surnageant et égouter le tube sur du papier filtre.
- Dissoudre le précipité dans 10 ml d'eau distillée
en agitant vigoureusement. On utilisera 1 ml de cette solution (solution
H) pour doser les globulines.
Mode opératoire
On réalise le dosage des protéines sur 10 tubes numérotés
0 à 9. Ne contenant pas de protéines, le tube N° 0
est un témoin (blanc). Les tubes 1 à 5 constituent la
gamme-étalon, correspondant à la l'albumine du sérum
bovin de concentration en protéines connue. Les tubes 6 à
9 correspondent aux solutions protéiques G et H, de concentrations
inconnues.
- Exercice spectrophotométrie
- Spectrophotometrie (Viéeo): loi de beer Lambert:
Le dosage des protéines est éffectué selon le tableau:


Résultats
- Tracer la courbe de densité optique à 750 nm en fonction de la quantité de protéines en microgrammes (gamme étalon).
- Déterminer les concentrations des protéines totales et des globulines dans le sérum de lapin. En déduire la concentration des albumines sériques.
Share this information on social mediaالإجتماعية
تبادل المعلومة عبر المواقع الإجتماعية الإجتماعية
 |
 |
 |
 |
 |
Méthode colorimétrique de dosage de Bradford
Bradford, M. (1976) Anal. Biochem. 72, 248 - 256. Cette méthode utilise le bleu de Coomassie (Brilliant Blue G-250) comme réactif qui réagit (dans des conditions de pH acide) avec l'Arginine (Arg) et, dans une moinde mesure, avec l'Histidine (His), la Lysine (Lys) et les acides aminés aromatiques. Le bleu de Coomassie se lie aux protéines par des interactions non-covalentes (ponts hydrogène, interactions hydrophobes et interactions ioniques). Sa longueur d'absorption maximale augmente de 465 nm (rouge) à 595 nm (bleu). le dosage est peu influencé par la présence d'autres molécules, sauf les détergents et les bases fortes. Détection de proteine de 1 µg/ml à 1,5 mg/ml.
B- Méthode de dosage basée sur la mesure directe de l'absorbance des résidus d'acides aminés chromophores : Trp, Tyr et Phe.
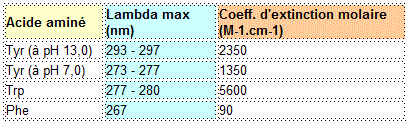
A des pH alcalins, le groupement phénol (radical R, pK3 = 10,07) des Tyrosines (Tyr) est ionisé en ion phénolate. Cette ionisation induit une augmentation du
coefficient d'extinction molaire avec un décalage de la longueur d'onde d'absorbance maximale (lambda = 293 - 297 nm). De ce fait, à des pH alcalins, on mesure essentiellement l'absorbance des Tyr.
A pH 7 (neutre), on mesure essentiellement l'absorbance des triptophanes (Trp) à 277 nm. Le groupement phénol des phénylalanines (Phe) contribue très peu à l'absorbance globale des protéines.
Précipitation des protéines au sulfate d'ammonium (relargage)
La précipitation des protéines par le sulfate d'ammonium (SA) permet de les fractionner selon leur solubilité. Cette méthode consiste à ajouter une quantité de SA dans la solution des protéines de façon à arriver à un degré (%) de saturation précis (à la température et au pH de travail). Il s'agit bien du pourcentage de saturation (donné par des tables) et non pas du pourcentage de concentration. Grâce à la centrifugation, on peut collecter (dans le culôt) les protéines précipitées et on élimine (dans le surnageant) les protéines encore solubles au degré de saturation en SA défini (protéines contaminantes). Pour déterminer la quantité de SA à ajouter on utilise un tableau de saturation.
Exemple:
on vise à récupérer une protéine en solution dans un volume de 250 ml et qui précipite entre 50% et 75% de saturation en SA. On procède de cette façon:
1/ Précipiter les protéines entre 0% et 50% de degré de saturation en SA. En se servant dut tableau ci-dessous, il faudrait tout ajouter 29.1 g de SA par 100 mL, soit 72,75 g de SA pour 250 ml. L'opération se fait addition dd SA 'petit à petit' sous agitation et avec la solution des protéines dans un becher maintenu dans la glace. On laisse précipiter et on centrifuge. Le culôt est écarté. Le volume du
surnageant est mesuré à l'aide d'une éprouvette.
Supposons que son volume n'a pas changé beaucoup (250 ml).
2/ On ramène le surnageant ( qui est à 50% degré de saturation en SA) à 75% de saturation en SA. Gâce au
tableau de saturation, on détermine la quantité de SA à ajouter. Elle est de 15,9 g/100 ml soit 39,75 g/250 ml. On précipite comme avant et après centrifugation on garde le culôt cette fois ci et on écarte le surnageant.
Tableau simplifié de saturation du sulfate d'ammonium (0°C, pH 7)
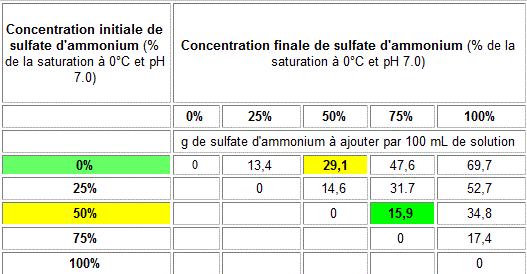
Les valeurs sont données en termes de % de saturation, c'est-à-dire en proportion de la quantité de sulfate d'ammonium nécessaire pour saturer complètement une solution d'eau à pH 7.0 à 0°C (5.35 mol/L) = 706,8 g de SA par litre d'eau. Ce tableau est simplifié pour des fins d'explication. Le tableau complet
donne des valeurs à tous les 5% de saturation.
Formulae for ammonium sulphate additions:
For the addition of saturated (NH4)2SO4 solutions, the volume changes on mixing are negligible. The volume (V) of saturated (NH4)2SO4 (in ml) which has to be added to 100 ml of solution of initial saturation S1 to produce a final saturation S2 is given by the equation: V = 100(S2-S1)/(1-S2), with S1 and S2 expressed as fractions of the saturated solution, e.g. S1 = 0.5 and S2 = 0.7.
Toutes les explications et les vidéos sur les techniques d'analyse et travaux pratiques dans le livre et le DVD support du livre 'Sciences de la vie. Protéines et Enzymes, 2013.
LIENS UTILES
Techniques en Biochimie. Préambule
- QCM Protéine (structure)
- QCM Protéines (liaisons)
- Acides aminés. Ionisation (Exercices)
- Protéines, peptides (contrôles)
- Biochimie-Techniques, Contrôle TP 2015

360 pages, 2018, ISBN : 978-9920-35-345-8 + DVD mis à jour + Assistance.

Comment avoir ces livres ? - أين يمكن اقتناء الكتب؟
Chaine
Youtube (abonnement). Vidéos multilingues

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.