

Ce projet d'étude de la relation Structure-Fonction des molécules est consacré à la peroxydase (بيروكسيداز) du raifort sous sa forme complexée à l'acide benzhydrozamique, un faux-substrat (fichier 2atj, disponible sur le répertoire 'Mecules data' du CD istribué au étudiants S6).
Les peroxydases sont des oxydoréductases très abondantes chez les plantes et d'autres organismes vivants. En plus d'autres fonctions, les peroxydases des plantes jouent un rôle important dans la croissance en agissant sur le taux de l'acide indole acétique (AIA).
يتعلق هذا المشروع بدراسة العلاقة بين التركيب والوظيفة للجزيئات مكرسة في إنزيم بيروكسيداز الفجل في شكله المعقد مع حمض البنزهيدروزامي، وهو ركيزة خاطئة (ملف 2 atj ، متاح في دليل "بيانات بالقرص المدمج الموزع على الطلبة). البيروكسيدازات هي إنزيمات للأكسدة والاختزال وفيرة جدًا في النباتات والكائنات الحية الأخرى.

Quelques informations sur les peroxydases.
Les peroxydases sont des protéines héminiques
L'étude classique du modèle (fichier 2atj, auteurs A.Henriksen et Coll., Protein Data Bank) d'une peroxydase du raifort permet aux étudiants de découvrir la structure de l'enzyme, avec une partie non protéique plane L'hème caractérisée par la présence d'un Fe III (donc en réalité hémine et non hème) au centre d'une porphyrine. Cette structure est à rapprocher de celle des globines étudiées par ailleurs. Il y a également 2 ions Ca++
Cas de la peroxydase de plantes complexée avec un faux substrat : fichier 2atj
Title: Recombinant Horseradish Peroxidase Complex With Benzhydroxamic Acid

Compound: Mol_Id: 1; Molecule: Peroxidase C1A; Chain: A, B; Synonym: Horseradish Peroxidase C1A, Hrp C; Ec: 1.11.1.7; Engineered: Yes
Authors: A. Henriksen, D. J. Schuller, M. Gajhede
Exp.Method: X-ray Diffraction
Classification : Oxidoreductase
EC Number : 1.11.1.7 (Peroxidase)
Source: Armoracia rusticana
Primary citation: Henriksen, A., Schuller, D. J., Meno, K., Smith, A.
T., Welinder, K. G., Gajhede, M.: Structural Interactions between Horseradish
Peroxidase C and the Substrate Benzhydroxamic Acid Determined by X-Ray
Crystallography Biochemistry 37 pp. 8054 (1998
- L'hémine est dans une poche limitée surtout par des résidus d'acides aminés hydrophobes Phe, Ala, Gly, Ile, Leu...) mais avec His 42, His 170 et Arg 38 qui dirigent chacun leur groupement polaire vers le noyau héminique (structure
JMOL des acides aminés)
La peroxydase présente deux 'zones':
1/ une zone proximale par rapport à l'hème. C'est à ce niveau que l'hème est rattaché à l'apoprotéine et
2/ une zone distale qui peut recevoir
le peroxyde et d'autres petites molécules comme l'eau, le monoxyde
de carbone (CO), le cyanide, le fluoride et l'azide. C'est dans cette
région que la sixième liaison de coordination avec le fer est réalisée.
- Le Fe III tend à établir avec son environnement immédiat 6 liaisons de coordinence avec des atomes donneurs d'électrons. Si les atomes donneurs sont à 'champ fort' (ex: N), ils imposent une répartition des électrons périphériques du fer qui le rend stable. C'est le fer 'bas-spin' peu réactif. Si les donneurs sont à champ plus faible (ex: O de l'eau), la répartition des électrons périphériques échappe à toute contrainte de leur part, le fer est dans un état électronique instable qui le rend très réactif: c'est le fer 'haut-spin'. Le fer peut également être pentacoordiné. Des techniques physiques permettent de repérer les "états" du fer.
- Le Fe III établit des liaisons avec les 4 atomes d'azote (N) de la porphyrine et avec un azote de His 170 (His proximal) situé à proximité. L'acide aminé His 42 (His distal)
situé à l'opposé est trop éloigné
pour établir la sixième coordinence. Une molécule
d'eau (eau distale) se trouve dans la zone (polaire) de la sixième
coordinence. Dans la peroxydase, le fer est dans un état 'haut-spin'.
Les étudiants peuvent restreindre l'environnement de l'hémine
à His 42, Arg 38, His 170 et éventuellement H2O 999
(HOH999).
La peroxydase présente deux atomes de calcium situés
dans les zones distale et proximale par rapport à l'hémine.
Chaque atome de calcum est heptacoordonné (7 liaisons) avec des
donneurs d'oxygène correspondant à: 1/ radicaux
des acides aminés comme COOH de Asp, OH de Ser et Thr et 2/ H2O
(eau distale).
Quelques données concernant le mécanisme réactionnel
Des techniques physiques ont permis d'analyser le mécanisme complexe de la catalyse qui ne sera pas exposé ici. On peut simplement retenir que c'est d'abord H2O2 qui est attiré dans la zone polaire
de la crevasse (site
actif, structure), au voisinage de His 42, Arg 38 et du Fer III,
l'arrivée d'une molécule de peroxyde déplaçant
la molécule d'eau distale. Une fois dans le site actif, H2O2
interagit avec des résidus d'acides aminés et l'hémine
ce qui conduit à la formation d'eau d'une part et à celle
d'un composé avec fer bas-spin, la sixième coordinence
étant alors" bien occupée". H2O2 est réduit.
Ensuite, c'est le 2ème substrat, gaïacol par exemple,
qui intervient. L'oxydation de 2 molécules de ce substrat est
nécessaire pour que l'enzyme et son groupement héminique
reviennent à l'état initial. Cela libère une deuxième
molécule d'eau.
Le cycle catalytique fait intervenir des transferts de H+ et d'e- .

- L'exploitation avec rastop (راستوب) du fichier 2atj permet de reconstituer un complexe peroxydase-acide benzhydrozamique. Le faux-substrat est en place dans la poche du site actif dans un environnement surtout hydrophobe mais à proximité de His 42, Arg 38 et de l'hémine.
- Les acides aminés His 42, Arg 38 et His 170, sont conservés dans les différentes peroxydases.
- Le remplacement de certains acides aminés par mutagénèse dirigée (préparation d'un gène synthétique
modifié puis exprimé dans E. Coli) complété par des études cristallographiques et/ou cinétiques fournit des renseignements sur le rôle des différents ac.aminés.
Effets sur l'affinité de la peroxydase pour H2O2.
Le remplacement de His 42 diminue toujours l'affinité de l'enzyme pour H2O2 et ralentit la réaction. La substitution de Arg 38 (polaire) par Leu (apolaire) diminue également l'affinité de l'enzyme pour H2O2 et surtout pour le 2ème substrat. Ces résidus ac.aminés semblent directement impliqués non seulement dans la formation des complexes avec les 2 substrats mais aussi dans la réaction proprement dite.
Effets sur la Vitesse maximale (Vmax) de la peroxydase.
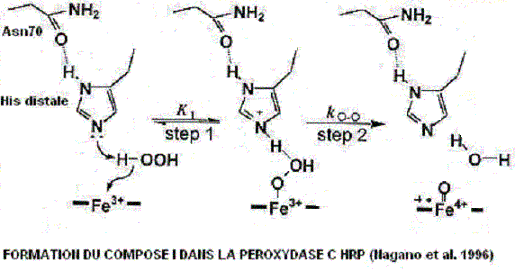
Le remplacement de l'asparagine Asn 70 par la valine Val 70 entraîne une baisse de Vmax de plus de 90% . Nagano et Coll. expliquent cela en considérant qu'entre Asn 70 et His 42 il peut y avoir une liaison hydrogène qui ne peut s'établir entre Val 70 et
His 42. Cette perte diminuerait la réactivité de His 42 et changerait sa position dans l'espace. Le modèle (2atj) en 3D ne montre pas cette liaison entre Asn et His.. On peut visualiser
Asn70
Environnement du site actif
- L'environnement surtout hydrophobe de l'hémine
L'hémine se trouve dans une poche limitée par des résidus ac.aminés surtout hydrophobes (zone apolaire) (Matériaux-liaisons),
les seuls groupements polaires à proximité appartiennent
à His 42, Arg 38 et His 170.
- Poche avec deux régions; l'une hydrophobe, l'autre hydrophile.
Le substrat est logé dans une poche dans laquelle il oriente
d'une part son cycle apolaire vers la partie hydrophobe constituée
par les Ac. aminés Phe179, Pro141, Ala140, Pro139, Phe 68, Gly
69 (+ une portion de L'hème) et d'autre part ses parties polaires
vers His 42 et Arg 38 , à proximité du fer.





Structure des peroxydases. Questions à réponse via RasTop
Peroxydase de navet (complexe avec l'acide benzhydroxamique)
1/ Structure primaire :
- Nombre d'acides aminés :
<Show sequence> : 307 acides aminé par chaîne x 2 chaînes
- Acides aminés N-terminal et C-terminal : N-terminal (Gln1),
C-terminal (Asn307)
2/ Structure secondaire :
- Nombre de pont S-S : <ssbonds> : 8 (= 4 x 2), ou <select
cys>
- Hélices alpha : ribbons : display
3/ Positionnement de l'hème et Calcium et des acides aminés du site actif (His42 (histidine distale), Arg38 et His170 (histidine proximale)
- <select ligand>, spacefill : heme, 2 Ca et BHO353 (acide benzhydroxamique)
- <select hetero> spacefill : heme, 2 Ca, BHO353 et molecules
d'eau
- mesurer distances entre His42 et Fe (Fe4779)
4/ Pourquoi BHO vient il se fixer dans la poche catalytique ?
- chaîne A en spacefill
- restrict within(10.0,BHO353)
- select bho353 + color yellow + Sticks
- write script pox_bho
5/ Comment il est orienté le BHO dans la poche catalytique ?
Visualisation de l'hème et des acides aminés du site actif. Liste des commandes RasTop:
1) set backgroung white (passer à la couleur blanche)
2) select ligand (selection de l'heme, du faux substrat et des atomes de Ca)
3) color red (+ display spacefill)
4) restrict :a (pour étudier une seule chaîne, respecter espace après restrict !)
A l'aide du curseur noter le Numéro de l'atome du fer (ici 4779).
5)
select atomno=4779 (atome Fe de l'heme),
rappel: pour connaître les coordonnées d'un atome, pointer dessus et lire les coordonnées dans la fenêtre des commandes)
6) color blue
7) select his42:a (histidine distale
de la chaîne a), (+ display ball & stick)
8) color orange
9) select his170:a (histidine proximale
de la chaîne a), (+ display ball & stick),
Exporter GIF ou le script ..pox1 pour toute sauvegarde (file -> export
-> script et enregister dans le répertoire où réside
l'application rastop. Le même résultat peut être
obtenu en saisissant la commande: write script pox1script. Le script
peut être ouvert par file -> open -> script -> ou par la commande
'script pox1script' dans la fenêtre des commandes)
Peroxydase. structure du complexe enzyme substrat
Visualisation du calcium
10)select ca351 (atome de calcium)
11) color green
12) select ca352 (atome de calcium)
13) color green
Visualisation de l'arginine 38
14)
select arg38:a
15) color cyan (+ display bakk & stick)
16) select BHO353:a (faux substrat = acide benzhydrozamique)
17) color magenta (+ display bakk & stick)
18) set picking label (permet d'activer l'annotation, sorte de 'stylo' lorsque vous pointez)
19) set picking ident (permet d'inactiver l'annotation)
Visualisation de la molécule d'eau entre His distale et Fe
20) select HOH999 (selection de la molécule d'eau 999)
21) color black (+ display ball & stick), (export GIF ..pox2)
22) write script pox1script (ceci permet d'appeler ce script si vous perdez l'image)
Rappels:
- Pour sélectionner toutes les Phe, saisissez dans la fenêtre des commandes 'select Phe'
- Pour sélectionner toutes les Phe de la chaîne a, saisissez
dans la fenêtre des commandes 'select Phe:a'
- Pour sélectionner toutes les molécule d'eau, saisissez
dans la fenêtre des commandes 'select HOH'
23)select HOH:a (sélectionner toutes les molécule d'eau de la chaîne a)
24) color black (+ display ball & stick), (export GIF ..pox3)
-
Peroxydases du cactus (Opuuntia ficus indica L.)
- Peroxydases du figuier de barbarie
- - Peroxydases de céréales
- Peroxydases des palmiers dattiers mâles et femelles
- Peroxydases des plantes. Théorie et pratique (Conférence de Baaziz, 2006)
- Etude cinétique de la peroxydase du palmier dattier et détermination du mécanisme de catalyse
- Structure 3D de la peroxydase du raifort. TP


360 pages, 2018, ISBN : 978-9920-35-345-8 + DVD mis à jour + Assistance.

306 pages, 2013, ISBN : 978-99-54-32-663-3 + DVD mis à jour 2018 + Assistance
Comment avoir ces livres ? - أين يمكن اقتناء الكتب؟
Chaine Youtube (abonnement). Vidéos multilingues

-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.