Enzymologie des réactions enzymatiques à plusieurs substrats. Cas de la tyrosine kinase du récepteur insuline et mode d'inhibition par les analogues de substrats.
Université
Cadi Ayyad, Faculté des Sciences-Semlalia, Marrakech, Morocco.
Examen de l'élément de module 'Relation sructure-fonction dans le métabolisme primaire et éléments de base du métabolisme secondaire des plantes', MODULE 'Biochimie, Génétique et Amélioration des Plantes', Parcours S5 : 'Biologie Appliquée aux Productions Végétales', Décembre 2015, Durée:
1 heure 15 min
Question 1 /15 points (Réponse 1)
Les
sous unités béta (transmembranaires) du récepteur de l'insuline sont dotées d'une activité, tyrosine kinase. Celle ci peut être évaluée en mesurant la phosphorylation d'un peptide de 13 acides aminés renfermant une tyrosine (Peptide-Tyr). La réaction peut être écrite
selon l'équation suivante :
Peptide-Tyr + ATP ----- Peptide-Tyr-P + ADP
La phosphorylation du peptide-Tyr (Pep-T) est évaluée en présence de différentes concentrations d'ATP et de Pep-T en présence de 25 ng de récepteurs.
Les vitesses de la réaction sont exprimées en picomoles de peptide phosphorylées par minute.
Les cinétiques de la tyrosine kinase sont étudiées en faisant varier, à chaque fois, l'un des substrats tout en maintenant l'autre substrat à une concentration constante. Elles sont représentées par les diagrammes primaires 1/v = f(1/(Pep-T) et 1/v = f(1/(ATP) qui ont l'allure d'un faisceau de droites. Les différentes droites des 2 diagrammes primaires font intersection avec les axes des
ordonnées en plusieurs points; bi, pour 1/v = f(1/(Ppep-T) et ci pour 1/v = f(1/(ATP). On en déduit 2 diagrammes secondaires respectifs, bi = f(1/(ATP)) et ci = f(1/( Pep-T) qui correspondent à des droites dont les intersections avec les axes sont résumées dans le tableau suivant :
| bi = f(1/ (ATP)) | ci = f(1/ (Pep-T)) | |
| Intersection
avec l'axe des ordonnées (picomole-1.min) |
0,53 | 0,53 |
| Intersection
avec l'axe des abscisses (µM-1) |
-0,059 | -2,38 x10-3 |
Les
types d'inhibitions exercées par deux analogues structuraux des
substrats Pep-T et ATP ont été étudiés.
Le peptide-Ser (Pep-S) (un analogue structural du Pep-Tyr où
la tyrosine phosphorylable a été remplacée par
une sérine) diminue l'affinité de l'enzyme pour le substrat
tout en maintenant stable la vitesse maximale de la réaction.
Inversement, Il est vis à vis de l'ATP sans effet sur l'affinité
de l'enzyme pour le substrat tout en diminuant la vitesse de la réaction.
L'AppNHp (un analogue de l'ATP dans lequel l'oxygène entre les
atomes de phosphore béta et gamma est remplacé par un
-NH-) est sans effet sur la vitesse maximale de la réaction mais
entraîne une diminution de l'affinité de l'enzyme pour
l'ATP. Vis à vis du Pep-Tyr, l'AppNHp s'avère un inhibiteur
sans effet sur l'affinité de l'enzyme tout en diminuant la vitesse
maximale de la réaction.
1. Sans considération des effets inhibiteurs exercés par
les analogues de substrats, proposer les mécanismes de la réaction
susceptibles de rendre compte des cinétiques de la tyrosine kinase.
Justifier votre réponse.
2. Préciser les types d'inhibition exercées par
les analogues structuraux des substrats.
3. En s'aidant des types d'inhibition obtenus avec les analogues
des substrats, déterminer le mécanisme de catalyse précis
de la tyrosine kinase. Donner le(s) shéma(s) de Cleland correspondant(s).
4. Déterminer tous les paramètres cinétiques
de la réaction enzymatique.
Question
2 /5 points (Réponse 2).
Quelles sont les conséquences cinétiques (mesurées à
travers les paramètres Km et Vmax) qui découlent des interactions
moléculaires ci-dessous, mises en évidence pour une enzyme
E, son substrat S et un inhibiteur I.
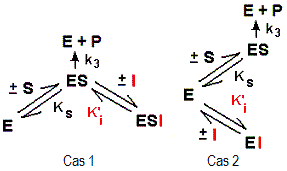
Réponses
Réponse
1 (Question 1)
1.Sans considération des données relatives aux types d'inhibition
par les analogues des substrats et tenant compte des cinétiques
1/v = f(1/(S) sous forme de faisceaux de droites faisant intersection
soit sur l'axe des abscisses soit au dessus ou au dessous du même
axe, les mécanismes de catalyse enzymatiques proposés pour
l'explication de la cinétique de la tyrosine kinase du récépteur
de l'insuline sont:
- Mécanisme au hasard fixation
dépendante.
- Mécanisme au hasard
fixation indépendante.
- Mécanisme séquencé.
2. Types d'inhibition de la tyrosine kinase du récepteur de l'insuline
par les analogues structuraux des substrats:
- L'analogue structural du substrat peptide-Tyr (Pep-Ser) ne peut être
que inhibiteur compétitif vis à vis du peptide-Tyr. Par
contre, il es inhibiteur non compétitif vis à vis de l'ATP, car il diminue Vmax sans chager la Km.
- L'AppNHp (un analogue de l'ATP) ne peut être que compétitif
vis à vis de l'ATP. Cependant, il est inhibiteur non compétitif
vis à vis du substrat peptide-Tyr, car diminue Vmax sans chager la Km.
3. Les types d'inhibition par les analogues des substrats (inhibitions non
compétitives) sont en faveur d'un mécanisme au hasard,
fixation indépendante. Le mécanisme au hasard, fixation
dépendante est à éliminer, car il est caractérisé
par des inhibitions mixtes par les analogues de substrats. De même
le mécanisme séquencé (ordonné) ne peut être
retenu, car donnant des inhibitions incompétitives par les analogues
de substrats. Donc le mécanisme de catalyse précis de la
tyrosine kinase du récepteur de l'insuline est un mécanisme
aléatoire (au hasard) à fixation indépendante où
la fixation d'un des deux substrats (S1 ou S2) n'influence pas la fixation
de l'autre (même chose pour les produits (P1, P2). le shéma
de Cleland correspondant peut être résumé comme suivant:
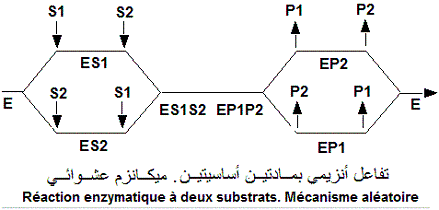
Plus de détail dans le livre 'Sciences de la vie. Protéines et Enzymes, 2013, pages 119-120.
Réponse
2(Question 2)
Les conséquences cinétiques (mesurées à travers les paramètres Km et Vmax) qui découlent des interactions
moléculaires montrées dans la figure:
- Cas 1 (à gauche de la figure): Linhibiteur I ne peut se fixer que sur le complexe enzyme-substrat (ES). Il ne peut réagir avec l'enzyme
seule. Sa fixation reste conditionnée par le substrat (S). Dans
cette situation, la constante Ks (Ks = [(E) x (ES)]/(ES), renseigne sur
l'affinité vis à vis de S, comme Km) va diminuer, car l'équilibre
E + S = = = ES sera déplacé en faveur de ES. Ks diminue
d'un facteur (1 + (I)/Ki'). Donc, I fait augmenter l'affinité de
l'enzyme vis à avis de son substrat. D'autre par, on note la formation
d'un complexe ternaire (ESI) non déplaçable par excès
de substrat, d'où diminution de Vmax d'un facteur (1 + (I)/Ki').
I est un inhibiteur incompétitif vis à vis de S.
Plus
de détail dans livre 'Sciences de la vie. Protéines et Enzymes,
2013, pages 89-91
- Cas 2 (à droite de la figure): Linhibiteur I ne peut se fixer que sur la forme libre de l'enzyme (E). Il ne peut réagir avec l'enzyme
seule. Dans cette situation, la constante Ks (Ks = [(E) x (ES)]/(ES),
renseigne sur l'affinité vis à vis de S, comme Km) va augmenter,
car l'équilibre E + S = = = ES sera déplacé en faveur
de E. Ks augmente d'un facteur (1 + (I)/Ki'). Donc, I fait diminuer l'affinité
de l'enzyme vis à avis de son substrat. D'autre par, on note la
formation d'un complexe binaire (EI) déplaçable par excès
de substrat, d'où Vmax inchangée. I est un inhibiteur
compétitif vis à vis de S.
Plus
de détail dans livre 'Sciences de la vie. Protéines et Enzymes,
2013, pages 84-89



Liens utiles:
- Enzymes et Métabolisme. Exercice
- Enzymologie-enzymes
(exercices)
- Comparaison Hexokinase et Glucokinase. Exercice
- QCM-Enzymes. Structure et fonction (bases)
- Hexokinase
- Coenzyme
Atransférase
- Amine
oxydase
- Inhibiteurs.
Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Enzymologie. Examen-1
- Enzymologie. Examen-2
- Enzymologie. Examen-3
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase. Examen S5
--> Retour à SOMMAIRE
PASSER UN CONTROLE NOTE ET COMMENTE SUR L'ENZYMOLOGIE

Ouvrages de la préparation de la transition Secondaire-Supérieur


-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
BIOCHIMIE. TP CONSIGNES (Vidéos)
Chaine Youtube (abonnement). Plusieurs vidéos multilingues

ANNONCES, INFORMATIONS
Congrès, Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo annonces
CONCOURS:
Concours de Pharmacie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.