En enzymologie, connaître comment les enzymes assurent la catalyse renvoie à l'élucidation de leur mécanisme, sans oublier que cela se passe par le contact du substrat avec l'enzyme à travers quelques acides aminés qui constituent le 'site actif'.
hexokinase (glucokinase) active le glucose lors de la glycolyse en le phosphorylant. Elle fonctionne selon un mécanisme séquencé (ordonné).
La Coenzyme A transférase (CoA-transférase) fonctionne selon un autre mécanisme, caractérisé par la formation de complexes binaire et une enzyme transitoire.
Correction de l'Exercice Hexokinase
Enoncé de l'exercice sur l'Hexokinase)
Glucose + ATP-Mg <--> Glucose 6-Phosphate + ADP-Mg
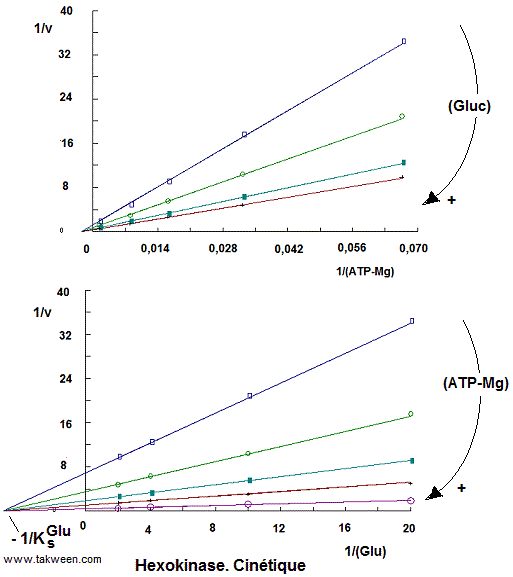
Les diagrammes primaires 1/v = f(1/(S)) en faisant varier l'ATP-Mg et
en maintenant constantes les concentrations du glucose, d'une part
et en variant le glucose (avec ATP-Mg constant) montrent que l'hexokinase
présente une cinétique sous forme de faisceau de
droites faisant intersection sur l'axe des abscisses. En enzymologie
à deux substrats, cette cinétique peut informer sur
la présence des mécanismes de catalyse: 1/ Mécanisme
au hasard fixation indépendante et 2/ Mécanisme
séquencé (ordonnée).
Les
expériences de la dialyse à l'équilibre réalisées en présence de l'enzyme et un des substrat (confrontation directe)
permettent de trancher sur le mécanisme de catalyse exact de l'hexokinase.
Résultats de la dialyse à l'équilibre avec ATP-Mg
| (ATP-Mg) en mM (S) | (ATP-Mg-Enz) en mM (RS) | (RS)/(S) |
| 0,2 | 0,01 | 0 |
| 0,5 | - 0,01 | 0 |
| 1,0 | 0 | 0 |
| 2,0 | 0 | 0 |
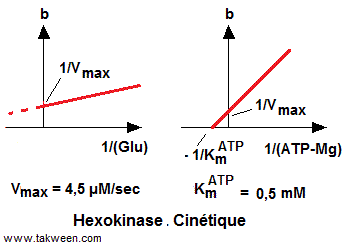
D'après ce résultat l'ATP-Mg ne se fixe plus sur l'enzyme libre (E). Il ne peux réagir qu'avec l'enzyme préalablement complexée avec le glucose (KmATP = 0,5 mM)
Résultats de la dialyse à l'équilibre avec le glucose:
| (Glucose) en µM (S) | (Glucose-Enz) en µM (RS) | (RS)/(S) |
| 20 | 6,4 (= 26,4 - 20) | 0,32 |
| 50 | 14,4 | 0,28 |
| 100 | 23 | 0,23 |
| 200 | 35 | 0,175 |
| 500 | 50 | 0,10 |
| 1000 | 58 | 0,06 |
| 2000 | 64 | 0,03 |
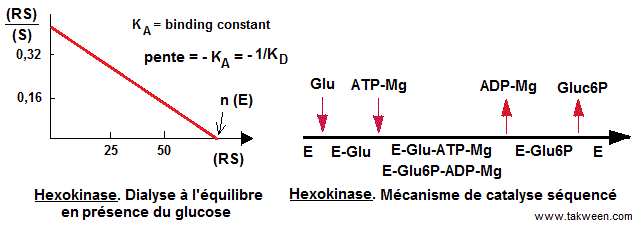
Le
tracé du graphique de Scatchard (Scatchard plot) permet de
déterminer la constante d'association (KA, binding constant).
KA = 1/KD, KD (constante de dissociation) = 0,2 mM. Cette valeur est
égale à KsGlu trouvée sur le diagramme primaire
(KsGlu = 0,2 mM). Ce ci démontre que le glucose présente
de l'affinité pour l'enzyme libre (E).
Le mécanisme de catalyse de l'hexokinase est un mécanisme
séquencé (ordonné) avec le glucose comme substrat
directeur (voir schéma de Cleland).
Calcul
du nombre de site de fixation du glucose par molécule d'enzyme
(hexokinase):
Dans le diagramme de Scatchard, le point d'intersection de la droite avec
l'axe des abscisses corresponf à n (E), avec n = nombre de
site de fixation du ligand (substrat) par molécule d'enzyme
et (E) la concentration d'enzyme (ici 35 µM). n est proche de
2. L'hexokinase est sous forme de dimère.
Liensutiles: comparaison
Hexokinase et Glucokinase
Correction L'exercice CoA transférase
(Enoncé de l'exercice sur la Coenzyme A transferase)
Mécanisme réactionnel de la réaction catalysée par la coenzyme A transférase:
succinyl CoA + Acétoacétate <--> Succinate + acétoacétyl
CoA
Les vitesse initiales (sens de la formation du succinate comme produit)
pour différentes concentrations en substrats sont données
dans le tableau ci-dessous. Elles sont exprimées en nanomoles
de produit apparu par minute et par mg d'enzyme.
1. Déterminer le mécanisme réactionnel de la Coenzyme A transférase (CoA-transférase).
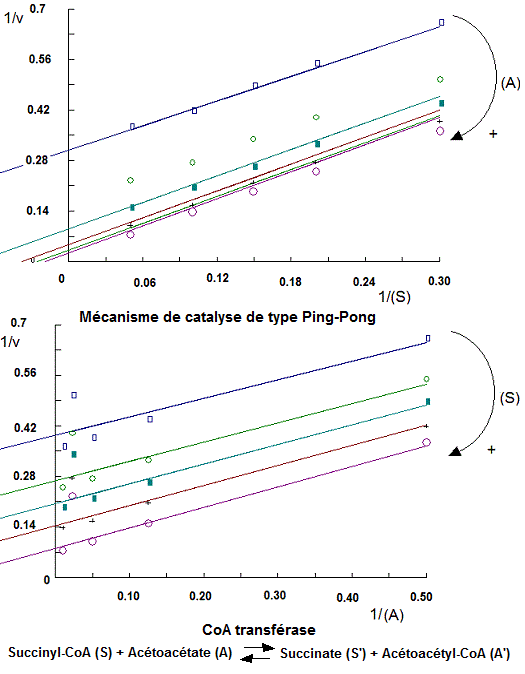
Tacés des cinétiques 1/v = f(1/(S):
Posons succinyl CoA = S, Acétoacétate = A, Succinate = S' et Acétoacétyl Co A = A'
Le tracé des diagrammes primaires 1/v = f(1/(S)), avec (A) constant et 1/v = f(1/(A)) avec (S) constant, donne des cinétiques sous formes de droites parallèles qui sont en faveur d'un mécanisme de catalyse Ping-Pong.
 |
 |  |
Correction L'exercice CoA transférase (suite)
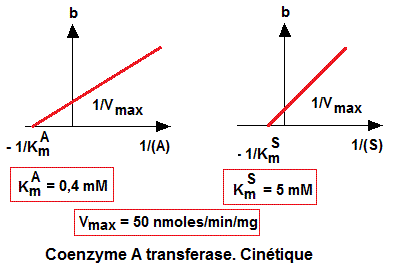
Le
tracé des diagrammes secondaires des points d'intersections
des droites 1/v = f(1/(S)) avec l'axe des ordonnées (points
b) en fonction des inverses des concentrations en substrat maintenu
constant, permet de calculer les paramètres cinétiques
Km relatives aux substrats. On obtient aussi la vitesse maximale (Vmax)
de la réaction.
2. Déterminer les paramètres cinétiques de cette
enzyme.
Lors du déroulement de la catalyse, il se forment uniquement des complexes enzymatiques binaires (absence de complexes ternaires). En plus, il y'a formation d'une enzyme transitoire qui est ici E-CoA.

avec S1 = Succinyl CoA, P1 = Succinate, E' = E-Co A, S2 = Acétoacétate et P2 = Acétoacétyl Co A
- Mécanisme
de catalyse à plusieurs substrats. Moyens d'étude
- Mécanisme de catalyse ping-pong
- Mécanisme de catalyse au hasard fixation indépendante
- Mécanisme ordonné (séquencé)
- Mécanisme de catalyse au hasard fixation dépendante
- Régulation enzymatique du métabolisme
- Enzymologie-enzymes
(exercices)
- QCM-Enzymes.
Structure et fonction (bases)
-
Hexokinase
- Coenzyme
Atransférase
- Amine
oxydase
- Inhibiteurs.
Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Phospholipase, Allostérie
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase.
Examen S5
- Phospholipase A2.Examen
Ouvrages de la préparation de la transition Secondaire-Supérieur


-
من علوم الحياة إلى البيوكيمياء
Des Sciences de la vie au Lycée à la Biochimie à l'Université
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
Takween. Supports
-Glossaire trilingues Français-Arabe-Anglais


Chaine
Youtube (abonnement). Plusieurs vidéos multilingues

Congrès, Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo annonces
CONCOURS:
Concours de Pharmacie
-
وحدات مسلك
علوم الحياة
Modules de la filière Sciences de la vie -
الولوج إلى
الجامعة
ACCES A L'UNIVERSITE
BIOCHIMIE. TP CONSIGNES (Vidéos)