Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
Takween. Sciences de la vie, Biochimie
Life Sciences, Biochemistry
علوم الحياة، بيوكيمياء
Cours -- TD -- TP
Transition Secondaire-Supérieur
إنتقال ثانوي - عالي
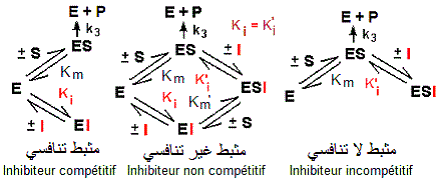
Les inhibiteurs réversibles des enzymes (مثبطات الإنزيم) peuvent être de différents types. Ici, il s'agit d'inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), D-Glycéraldéhyde-3-phosphate déshydrogénase (GPDH) et acétylcholine estérase
| French | Arabic | English |
| Enzymes, inhibiteurs | إنزيمات، مثبطات | Enzymes, Inhibitors |
Inhibiteurs de L'enzyme de conversion de l'angiotensine (ECA)
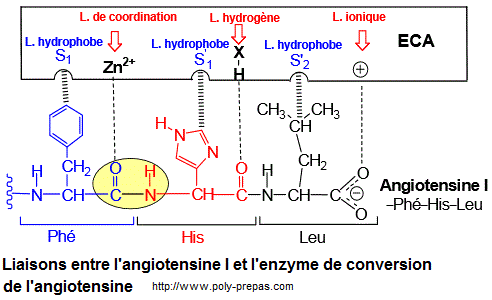
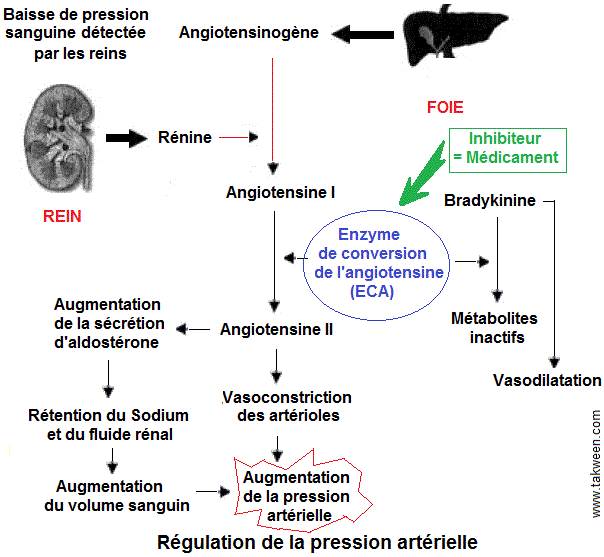
L'enzyme de conversion de l'angiotensine (enzyme de conversion (ECA, EC 3.4.15.1) est une exopeptidase qui catalyse la conversion de l'angiotensine I en angiotensine II, un puissant vasoconstricteur.
Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu (Angiotensine
I) --> Asp-Arg-Val-Tyr-Ile-His-Pro-Phe (Angiotensine II)
les inhibiteurs de l'ECA entraînent un relâchement des
vaisseaux sanguins, ce qui diminue la pression artérielle. Ainsi, le cœur n'a pas besoin de travailler aussi fort pour envoyer le sang dans tout le corps. Ces inhibiteurs sont des médicament. Les inhibiteurs de l'enzyme de conversion de l'angiotensine I présentent pour la plupart un motif structural commun apparenté au dipeptide L-Alanyl-L-Proline.
Des études de relation structure-fonction ont permis l'émergence de puissants inhibiteurs à partir d'une série représentée par le composé 1 (figure cidessous). L'activité inhibitrice de ces produits est évaluée par leur concentration inhibitrice 50% (CI50) en µM (voir tableau, source: https://www.remede.org).
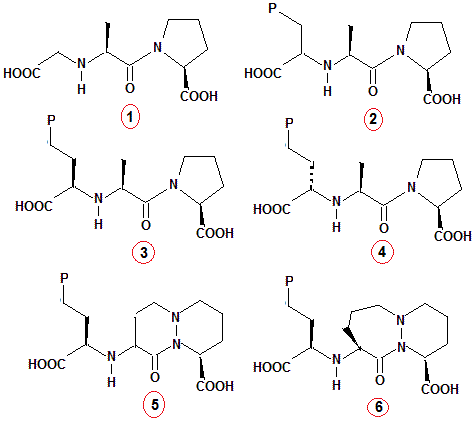
| Composé | CI50 (µM) |
| 1 | 2,400 |
| 2 | 0,040 |
| 3 | 0,001 |
| 4 | 0,800 |
| 5 | 0,028 |
| 6 | 0,016 |
1/
Pourquoi la configuration des carbones chiraux a-t-elle une influence déterminante sur l'activité de ces molécules ? Combien de centre(s) d'asymétrie les molécules 3 et 4 présentent-elles ?
2/ En comparant les structures des composés 1 à 3, quelle propriété physicochimique se trouve modifiée ? Justifier son influence sur l'activité de ces molécules.
3/ Comparer et commenter les activités pharmacologiques des composés 3 et 4.
4/ Le composé 3 est le métabolite actif de l'énalapril.
Quelle différence structurale
existe-t-il entre le composé 3 et l'énalapril ? Concernant l'énalapril, comment appelle-t-on ce type de composé et quel est l'intérêt de cette modification chimique ?
5/Les composés 5 et 6 résultent du remplacement de la L-proline par un système
bicyclique. Quelle est la conséquence de cette modification sur le plan conformationnel ?
Réponses
1/ La configuration des carbones chiraux joue sur la géométrie des parties actives de la molécule. En effet, l'interaction entre ces molécules et le site catalytique de l'enzyme est stéréo-spécifique. Les molécules 3 et 4 présentent 3 centres d'asymétrie (voir les notions de chimie).
2/ L'introduction sur la chaîne d'un substituant -benzyle (composé 2) et surtout -phényléthyle (composé 3) augmente la lipophilie des molécules qui favorise l'interaction hydrophobe au niveau de la poche S1 lipophile de l'enzyme, ce qui renforce l'affinité et donc leur activité inhibitrice (CI50 inférieures).
3/ Dans le composé 4, la stéréochimie du centre de chiralité est inversée, l'interaction hydrophobe avec la poche S1 est donc fortement réduite, ce qui se traduit par une activité 800 fois plus faible que celle du composé 3 (CI50 800 fois plus grande).
4/ Le composé 3 est utilisé sous forme de monoester éthylique. Cet ester est moins ionisé ce qui permet une meilleure résorption. Il est transformé par les estérases hépatiques. L'énalapril constitue une prodrogue.
5/ La création d'un seul cycle lactame a pour conséquence
de figer la chaîne dans la conformation la mieux appropriée au regard des sites d'action de l'enzyme
Inhibiteurs de L'enzyme D-Glycéraldéhyde-3-phosphate déshydrogénase
La
D-glycéraldéhyde-3-phosphate déshydrogénase de muscle de lapin est un tétramère de poids moléculaire 136000, constitué de quatre sous-unités
identiques portant chacun un site actif. L'enzyme catalyse la réaction suivante :
D-Glycéraldéhyde-3-phosphate + NAD+ + Pi <===> 1-3-diphosphoglycérate + NADH+
Les vitesses initiales (exprimées en variation d'absorbance par
minutes, delta A340 min-1) obtenues pour différentes concentrations
de NAD+ et mesurées par l'apparition de NADH à 340 nm
(Coef.extinction molaire = 6220 M-1 cm-1) sont présentés
en absence (v) et en présence (v') de 10-8 M d'inhibiteur,
l'acide iodoacétique.
a.
Déterminer les paramètres cinétiques de l'enzyme.
b. Quelles conclusions déduisez-vous de l'expérience avec l'acide iodoacétique, sachant que la concentration de l'enzyme dans les 2 expériences, exprimée en tétramère, est de 5 x 10-9 M. Information: l'iodoacétate peut former une liaison, covalente avec l'enzyme.
Réponses
La détermination de Km et Vmax par la courbe de Michaelis ne peut être faite avec précision, car, cela nécessite l'obtention d'un plateau dans les représentation v = f((S)). La linéarisation sous forme 1/v = f(1/((S)) permet d'avoir plus de précision.
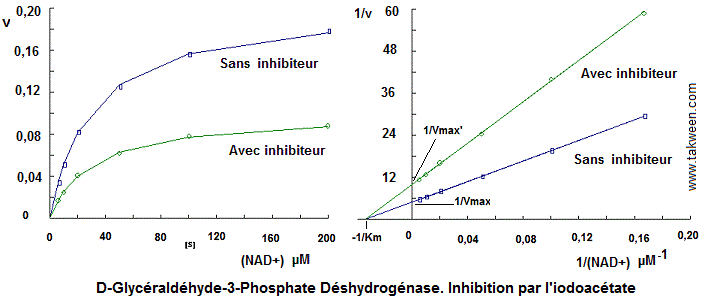
Les droites des inverses (représentations de Lineweaver-Burk) donnent des vitesses maximales en absence (Vmax) et en présence (Vmax') d'inhibiteur différentes avec des Km identiques. En effet, les deux droites se rencontrent sur l'axe des abscisses au point égal à - 1/ Km qui est égal à 0,03375, ce qui donne une valeur de Km égale à 29.8 µM. 1/Vmax = 5, soit un Vmax égal à 0,2 A/min. 1/Vmax' = 10, ce qui donne Vmax' = 0,1 A/min.
l'inhibition par l'acide iodoacétique exercée vis à vis de NAD+ est une inhibition non compétitive. Mais, ce n'est pas le cas et nous sommes en présence d'une inactivation partielle de l'enzyme qui a lieu suite à une fixation covalente entre l'enzyme et l'inhibiteur. Ainsi, l'enzyme qui réagira avec le substrat est celui qui n'a pas réagi avec l'inhibiteur.
Si
[Io] < [Eo], la concentration d'enzyme actif restant sera :
(E0)' = (E0) - (I0), Vmax' = k2(E0)' = k2[(E0) - (I0)]
Exprimons la concentration par monomère : 5 x 10-9 M x 4 =
2 x 10-8 M.
Pour une réaction covalente entre deux corps chimiques A et
B, les concentrations de A et B qui vont se lier sont identiques.
Ainsi, après incubation en présence d'inhibiteur, la
concentration en site actif (Eo)' est égale à 10-8 M.
Donc: Vmax' = k2(E0)' = k2(E0)/2 = Vmax/2
En effet, nous constatons que la vitesse maximale ainsi que toutes
les vitesses enregistrées en présence d'acide iodoacétique
sont égales à la moitié des vitesses obtenues
en son absence. Ainsi, l'acide iodoacétique induit une inactivation
partielle de l'enzyme.
Inhibiteur de l'acétylcholine estérase
L'acide
1-anilino-8-naphthalene sulfonate (ANS) est un inhibiteur de l'acétylcholine estérase. Pour déterminer la nature de l'inhibition, on a mesuré les vitesses initiales d'hydrolyse de l'acétylcholine (ACH), à différentes concentrations de ce substrat, en absence d'ANS (sans A), en présence d'ANS aux concentrations de 1,07 x 10-4 M et 2,05 x 10-4 M d'ANS. Le tableau suivant donne les vitesses initiales exprimées en µM d'acétylcholine hydrolysé par minute et par mg de protéine et obtenues en absence et en présence d'inhibiteur.
| v (µmoles/ min/ mg protéines) | |||
| (ACH) mM | Sans ANS | Avec ANS 1,07 x 10-4 M | Avec ANS 2,05 x 10-4 M |
| 0,165 | 66 | 35 | 40 |
| 0.220 | 82 | 39 | 45 |
| 0,330 | 107 | 44 | 52 |
| 0,450 | 130 | 47,5 | 56,5 |
| 0,550 | 143 | 49,5 | 59 |
| 0,660 | 156 | 51 | 61 |
Déterminer les paramètres cinétiques (Km et Vmax) de l'acétylcholine estérase et le type d'inhibition qu'exercce l'ANS vis à vis de l'ACH. Dterminer la constante de dissociation du complexe Enzyme-Inhibiteur (Ki).
Réponse
D'après les valeurs des vitesses, on constate qu'en augmentant la concentration d'inhibiteur la vitesse augmente, mais sans atteindre les vitesses obtenues en absence d'inhibiteurs. Pour connaître le type d'inhibition exercée par ANS vis à vis du substrat qui est l'acétylcholine (ACH), on trace les courbes 1/v = f(1/(S)) (représentation de Lineweaver-Burk).
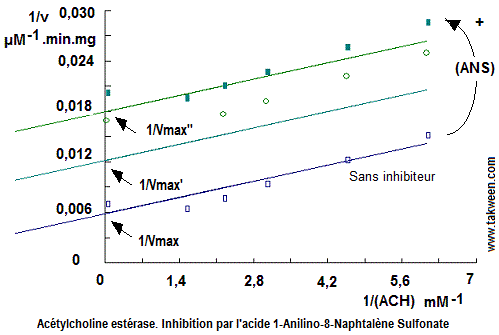
Les droites des inverses (1/v = f(1/(S)) sont parallèles indiquant que l'inhibition par l'ANS est incompétitive vis à vis de l'ACH. La droite (sans inhibiteur) obtenue en absence d'ANS permet de calculer les valeurs de Km ( = 0.236 mM) et de Vmax
(= 171µM) d'acétylcholine hydrolysé par minute et par mg de protéine).
Le calcul de Ki peut se faire grâce aux valeurs de Vmax et / ou Km obtenues en présence de l'inhibiteur. En effet l'inhibiteur incompétitif se fixe uniquement sur la forme de l'enzyme complexée avec le substrat (inhibiteur conditionnel). Il va stimuler son interaction
avec le substrat en augmentant l'affinité (Km diminue). Cependant, l'inhibiteur fait diminuer Vmax, car il forme un complexe ternaire ESI non déplaçable par excès de substrat.
En présence d'inhibiteur: Km' = Km/(1 + (I)/Ki) et Vmax' = Vmax/(1 + (I)/Ki)
Exemple de calcul avec la concentration de ANS = 1,07 x 10-4 M:
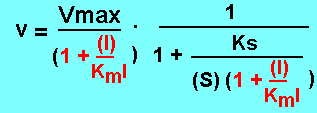
1/Vmax' = 0,0119 µmole-1.min.mg ce qui donne Vmax' = 84,033 µmoles/min/mg protéines.
84,033 = 171/(1 + 1,07 x 10-4/Ki), ce qui donne Ki = 1,033 x 10-4 M
- Mécanisme
de catalyse à plusieurs substrats. Moyens d'étude
- Mécanisme de catalyse ping-pong
- Mécanisme de catalyse au
hasard fixation indépendante
- Mécanisme de catalyse au ordonné
(séquencé)
- Enzymologie-enzymes
(exercices)
- QCM-Enzymes.
Structure et fonction (bases)
- Enzymes, métabolisme. Exercices
- Hexokinase
- Coenzyme
Atransférase
- Amine
oxydase
- Inhibiteurs.
Applications
- QCM-Inhibiteurs-1
- QCM-Inhibiteurs-2.
- Phospholipase, Allostérie
- Citrate synthétase, Peroxydase (Examen)
- Chélatase, Aspartate transcarbamylase. Examen
- Enzymologie. Examen 4
- Enzymologie. Examen 5
- Polyphénoloxydase.
Examen S5
- Phospholipase A2.Examen
- Livre 'Sciences de la vie. Protéines et Enzymes', Baaziz 2013:

306 pages, 2013, ISBN : 978-99-54-32-663-3 + DVD mis à jour 2018
+ Assistance
- Livre 'Structures et Métabolisme des Sucres', Baaziz, 2018(+ DVD, 400 QCM):

- Présentation
du livre
- Afiche annonce du livre
Actions takween
pour la promotion de la culture scientifique et la réussite de la transition
Lycée-Université
تكوين. دعم الثقافة العلمية و مواكبة الانتقال
من الثانوية إلى الجامعة
Afin de pouvoir continuer à servir les visiteurs, soutenez nos actions sur le site takween en faisant acquisition des ouvrages et supports pédagogiques desitinés à améliorer l'enseignement et la recherche scientfique en Biochimie.
Chaine Youtube (abonnement).
Plusieurs vidéos multilingues
- تحميل ملفات في مواضيع البيوكيمياء Téléchargement de fichiers en Biochimie

- آفاق الدراسات بكليات العلوم و رد الاعتبار لمؤسسات ا لتعليم العالي ذات الاستقطاب المفتوح
- Congrès,Conférences,...
- Congrès, Conférences
- Cours, Workshops
- Bourses, Postdocs
- Biotech-ecolo. annonces